> 影视
二氧化碳的制备与利用教案(二氧化碳的制备与利用笔记)
导语:二氧化碳的制备与利用
三、二氧化碳的制备与利用
1. 工业制备二氧化碳:
高温煅烧石灰石:CaCO3 = CaO + CO2↑(条件:高温)
石灰石的主要成分是碳酸钙,碳酸钙是白色的固体,难溶于水
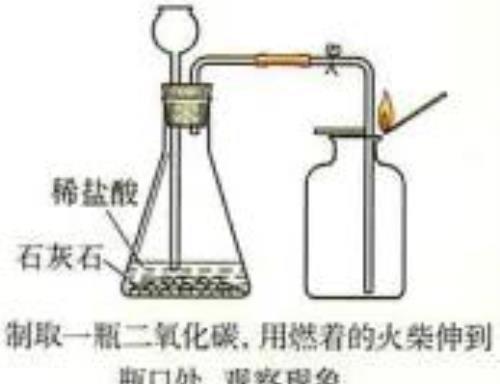
2. 实验室制备二氧化碳
(1)原料:石灰石或大理石和稀盐酸
不用浓盐酸代替稀盐酸的原因:浓盐酸有挥发性,挥发出氯化氢气体,使制得的二氧化碳不纯
不用稀硫酸代替稀盐酸的原因:反应生成的硫酸钙微溶,覆盖在大理石表面,阻止反应发生
不用粉末状石灰石、纯碳酸钙、碳酸钠代替块状石灰石的原因:反应速率太快,不利于气体收集
(2)原理:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
(3)发生装置:固体-液体-常温型
(4)收集方法:向上排空气法
(5)实验步骤
组装仪器,检查装置气密性,将石灰石放在锥形瓶中,从长颈漏斗中倒入稀盐酸,收集气体
(6)验满的方法:在集气瓶口放一燃着的木条,若木条熄灭,则满
(7)注意事项
二氧化碳中可能混有的杂质为:氯化氢、水蒸气;除去氯化氢用饱和碳酸钠溶液,除去水蒸气用浓硫酸
制得的二氧化碳通入澄清石灰水,没变浑浊,可能原因是:盐酸浓度太大,使二氧化碳中混有大量氯化氢、石灰水变质
四、二氧化碳与人体健康
1. CO2无毒,不是大气污染物
2. 空气中CO2的体积分数为1%,人感到气闷头晕心悸,6%以上使人神志不清,呼吸停止,以致死亡
3.进入菜窖、溶洞、深井等CO2含量较高的地方,应进行灯火实验,若火焰微弱或熄灭,说明CO2含量高不易进入,同时应通风换气
本文内容由小竹整理编辑!