核外电子排布是什么意思(核外电子得失)
导语:怪事!有些核外电子不按常规出牌,破坏了构造原理
怪事!有些核外电子不按常规出牌,破坏了构造原理
文/袁玉刚 图/源于互联网
1920年前后,尼尔斯·玻尔提出了构造原理:设想从氢原子开始,随着原子核电荷数的递增,原子核每增加一个质子,原子核外便增加一个电子,大多数元素的电子按能量由低到高的顺序依次填入核外电子运动轨道。
对于同一能级,当电子排布为全充满(d10,元素Cu铜)或半充满(d5、f7,Au 、Ag银)、全空(Pd钯)时,能量较为稳定。
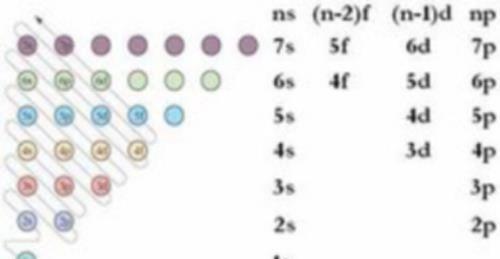
但是,原子的核外电子并不是完全按照能级层顺序依次排布的,即不完全是排满n能级层后再排(n+1)能级层,而是按照图1所示的能级顺序排布。
图1 电子能级图
图1中,每个小圆圈表示一个能级。每一行表示一个能级层,从左到右、自下而上能量依次升高。各圆圈连线的顺序表示随核电荷数递增而增加的电子填入能级的顺序。可以看出,从第三能级层开始,出现了能级交错现象。能级顺序遵循1s、2s、2p、3s、、4s、3d、4p、5s、4d、5p、6s、4f、5d……
相信大家学过这个能级图,不会感到生疏吧!
为什么核外电子并不完全按照能级层顺序依次排布,而是另有图径呢?为什么4s优先于3d;为什么5s优先于4d、4f;为什么5p优先于4f;为什么6s优先于4f、5d;为什么6p、7s优先于5f、6d?
核外电子并不完全按照能级层顺序依次排布,一是能级层不合理,一是能级有误。这些能级都是实验验证过的,只有能级层不合理,或者说元素周期表排得有问题。许多人都不会接受这个想法。你能接受吗?
那么,能级层出了什么问题呢?
我用我的旋涡模型把《元素周期表》中的第三、第四周期合并为原子周期表中的第三周期;元素周期表中的第五、第六和第七周期合并为原子周期表中的第四周期,就有效解决了能级顺序问题。原来,所谓的s层只是原子旋涡里的两个主旋臂。四个大层里面的1s、2s、3s、5s。4s、6s、7s只是优先占据了主旋臂。而p区虽然归属于主旋臂,但却是发叉来的。d区是发叉来的副旋臂。f区则更是发叉来的副旋臂。
在原子周期表中的第一周期,两个小层的两条主旋臂可以容纳4个核子,核内质子和核外电子彼此纠缠,相互吸引,质子或核外电子最大只能有二分之一,所以只能有两个元素,并且都在主旋臂上即1s。
在原子周期表中的第二周期,旋臂发叉,四个小层的四条主旋臂可以容纳16个核子,质子即核外电子最大只能有二分之一,所以只能有8个元素,并且都在主旋臂上即2s、2p。
在原子周期表中的第三周期,旋臂再次发叉,出现四条副旋臂。八个小层的八条旋臂可以容纳64个核子,质子即核外电子最大只能有二分之一,所以只能有32个元素。此时,四条主旋臂上有16个元素,即3s、、4s、4p;其余16个元素则在四条副旋臂上。可惜科学家们只找到10个元素,于是把它们叫做d区元素。剩下6个位置只有让中子占据。从此,中子数多于质子了。4s之所以优先于3d,是因为4s在主旋臂上,就好像蜘蛛网上的主经线;而3d在发叉的旋臂上,就好像蜘蛛网的副经线。这就是主旋臂节点优先原则。这样就解释了能级交错现象和副族元素的来源。
在原子周期表中的第四周期,旋臂再次发叉,又增加八条次级副旋臂。十六个小层的十六条旋臂可以容纳256个核子,质子即核外电子最大只能有128个元素。此时,四条主旋臂上有64个元素,即5s、5p、6s、6p、7s、7p;四条副旋臂上有64个元素,即5d、6d、7d30个元素;八条次级副旋臂上有128个元素。可惜科学家们只找到28个元素,于是把它们叫做f区元素即6f、7f。剩下的许多旋臂节点让中子占据。还有更多的小层等待新的元素。中子数大大多于质子了。此时,不仅主旋臂节点优先,副旋臂也有等级差别了。于是,不仅5s优先于4d、4f,6s优先于4f、5d,7s优先于5f,而且5p也优先于4f,6p优先于5f。
图2 旋臂分叉图
能级层的错误导致能级交错现象。其实,只要把d升一级、f升两级就解决问题了。能级图太机械了。
我的能级排列表如下:
原子壳层 能级
Ⅳ 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Ⅲ 3s 4s 3d 4p
Ⅱ 2s 2p
Ⅰ 1s
需要说明的是:每一种元素的形成都是一种旋涡旋聚的结果,并不是在前一种元素基础上的质子或电子的递次增加,更不是恒星里核聚变的能量的递次增加。所谓的能级只是某些元素能量的人为排列。这种元素里的p、d、f电子的能级与另外一种元素的p、d、f电子的能级未必相同。
本文内容由小涵整理编辑!