稳定细胞系构建原理(稳定细胞系构建什么意思)
导语:稳定细胞系构建
稳转细胞植株构建的常备技术方法
1基因过表达稳转细胞细胞系构建
(基因过表达多克隆细胞株构建服务、基因过表达单克隆细胞株构建服务):
因过表达细胞株构建服务包括目的基因过表达慢病毒载体构建、病毒包装、细胞转染和筛选。客户只需提供目的基因的cDNA质粒和需要构建的细胞系,我们将按照您的要求完成目的基因过表达细胞株的构建和检测,提供给您高质量的基因过表达稳定细胞株。
2RNA基因敲减稳转细胞株筛选
(RNA干扰基因敲减细胞株多克隆构建服务、RNA干扰基因敲减细胞株单克隆构建服务):
我司的RNAi基因敲减细胞系构建基于慢病毒表达系统,一般采用U6启动子驱动的pLVshRNA-puro或pLVshRNA-EGFP(2A)puro载体构建RNA干扰稳定细胞株,服务内容包括干扰载体构建、靶点筛选、干扰效率验证及稳定细胞筛选和克隆。
3CRISPR基因敲除稳定细胞株构建服务:
随着TALEN和Cas9/gRNA基因敲除系统的出现,基因定点敲除的难度大幅下降。全新的技术将基因敲除从价格高昂,耗时漫长的ZNF系统,逐渐变成简便的研究工具。现在我们可提供Talen和Cas9/gRNA两个系统的基因敲除服务。包括基因敲除靶点设计,TALEN质粒组装,Cas9/gRNA质粒构建及基因敲除效率验证。
稳定细胞株筛选方法
1转染质粒后,单克隆方法筛选稳定细胞系:
对大多数细胞转染效率较低。对于基因过表达,如果转染效率达到40%,基因过表达尚可。但是对于基因干扰实验,对转染效率要求远远高于基因过表达,通常质粒转染无法满足。
另外,质粒游离于细胞质中,很快降解,无法满足较长时间的检测项目;质粒转染整合几率极低,稳定细胞株构建耗时耗力,且得率很低,往往需要挑取单克隆株。
2病毒感染筛选稳定细胞株:
病毒感染方法较质粒转染筛选单克隆方法更方便和高效,是目前主流的稳定细胞系筛选方法。用慢病毒制备稳转细胞株,由于其高效整合、高效转录、高效表达、宿主范围广,感染效率高,且与细胞染色体整合而不发生基因重排,是制备稳定细胞株的理想载体。
稳转细胞株的一般服务流程
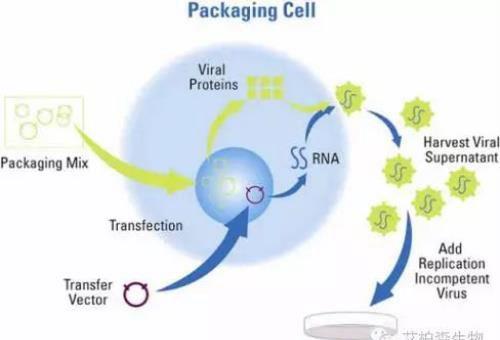
1 载体构建&病毒包装
一般而言,将人源化的抗体基因转接到慢病毒载体上,然后对质粒表达进行检测,通过包装获得过表达目的基因的慢病毒质粒。慢病毒载体系统的包装成分与载体成分一起转染293细胞进行包装;24至48小时后,收集富含慢病毒颗粒的细胞上清液,浓缩后进行滴度测试。
图1 病毒包装&细胞感染
2 细胞转染
常用的真核表达载体的抗性标志物有嘌呤霉素(Puromycin)、潮霉素(Hygromycin)和新霉素(Neomycin)。首先确定Puromycin/G418的筛选浓度和病毒转染浓度,然后病毒悬液转染细胞24h,Puromycin/G418筛选稳转株,ELISA和WB法鉴定。
3 单克隆化
使用Molecular ClonePix2系统,高通量、自动化的筛选出100-200个高水平分泌克隆,并从中挑选最佳10个高产克隆,进行下一步的稳定性测试。
4 细胞系稳定筛选
细胞株多次传代数次后,就有可能会出现遗传不稳定性。我们挑选出最优的10个克隆,进行10次传代后,qPCR和WB法检测细胞株的稳定性。最后我们提供序列及载体报告, 3株表达最好的细胞株,表达分析、稳定性测试报告以及详细的稳定细胞株构建报告。
本文内容由小凡整理编辑!