练就“火眼金睛”(练就火眼金睛的故事)

前言
在化学的应用能力要求中,根据某些性质检验和区分一些常见的物质是经常会出到的题型,也是考试时错误率比较高的一类题。要让自己轻松驾驭这类题型,需要从物质性质与做题技巧两方面来把握。

物质特性梳理
做检验、鉴别题的根据是物质的特征性质。一种物质会表现有多种性质,而用于检验、鉴别的性质应该是该物质独有的,或者就是本题中与其他物质有区分性的性质。
初中常见的用于检验、鉴别物质的特征性质归纳如下
1.常见固体和溶液的颜色
固体的特殊颜色:
紫黑色:高锰酸钾
绿色:碱式碳酸铜
红色:铜(有金属光泽)、氧化铁(或红棕色)、红磷
蓝色:氢氧化铜
黑色:炭粉、铁粉、氧化铜、二氧化锰、四氧化三铁
黄色:金(有金属光泽)、硫(淡黄色)
红褐色:氢氧化铁
没有特殊颜色的固体通常是白色固体
溶液的特殊颜色:
浅绿色溶液:亚铁盐
黄色溶液:铁盐
蓝色溶液:铜盐
紫红色溶液:高锰酸钾
没有特殊颜色的溶液通常是无色溶液
2.常见气体的特性
能助燃:氧气
不能助燃:二氧化碳、氮气
(二氧化碳能使澄清石灰水变浑浊;氮气不能)
能燃烧:氢气、一氧化碳、甲烷
(氢气:燃烧产物只有水;一氧化碳:燃烧产物只有二氧化碳;甲烷:燃烧产物有二氧化碳和水)
氨气:有氨臭气味;能使湿润的红色石蕊试纸变蓝
二氧化硫:有刺激性气味;能使稀高锰酸钾溶液从浅紫红色褪成无色
3. 常见酸、碱、盐的特性
①物理性质:
可用于检验、鉴别的物理性质除了颜色,还有固体溶解性的不同;溶解时的温度变化不同;溶于水时溶液的颜色不同。
碱的溶解性:只有钾、钠、钡离子的碱易溶于水,氢氧化钙微溶,其他碱难溶
盐的溶解性:
氯化物不溶氯化银,其余都易溶;
硫酸盐不溶硫酸钡,硫酸钙、硫酸银微溶,其余都不溶;
碳酸盐只溶钾、钠、铵的盐,其余都不溶
溶解时溶液温度变化:硝酸铵溶解时温度降低;氢氧化钠溶解时温度升高
②化学性质(离子特性):
酸溶液(氢离子):使紫色石蕊试液变红;使蓝色石蕊试纸变红;与活泼金属反应产生气泡;与碳酸盐反应产生气泡;使不溶性的金属氧化物、不溶性碱溶解
碱溶液(氢氧根离子):使紫色石蕊试液变蓝;使红色石蕊试纸变蓝;与可溶性铜盐反应产生蓝色沉淀,与可溶性铁盐反应产生红褐色沉淀。
碳酸盐(碳酸根或碳酸氢根离子):与盐酸反应产生气体,且气体能使澄清石灰水变浑浊
铵盐(铵根离子):与浓氢氧化钠溶液一同微热(固体可与熟石灰混合研磨),产生有氨臭气味的气体,气体还能使湿润的红色石蕊试纸变蓝
硫酸盐(硫酸根离子):与氯化钡溶液反应产生白色沉淀,且沉淀不溶于稀盐酸
氯化物(氯离子):与硝酸银溶液反应产生白色沉淀,且沉淀不溶于稀硝酸
4. 常见的有机物的特性
淀粉:遇碘水或碘酒呈蓝色
葡萄糖:与新制的氢氧化铜悬浊液混合,加热至沸腾,产生砖红色沉淀
蛋白质:(固体形式)灼烧,产生烧焦羽毛气味;(溶液中)与浓硝酸一同微热,产生黄色凝聚物
聚乙烯与聚氯乙烯:点燃后闻气味,聚乙烯:没有气味;聚氯乙烯:有刺激性气味
做题方法梳理
当检验题以填空形式出现,涉及实验的完整叙述;当检验、鉴别题出现在选择题中,主要考虑实验方法的选择。

1. 关于取样
一般不能将试剂加到全部样本中进行检验,应取少量样品进行,即“取样”。
若一次实验不能完全区分开,需要再对余下样品进行实验,可以重新取样,再加试剂检验。
若需要对前面反应后的所得物质进行检验,需要弄清楚是取前面实验后得到的沉淀,还是取上层清液来进行实验,并详细书写怎样取样。
2. 关于实验
选择检验、鉴别试剂或方法的条件:现象区分明显;条件容易实现(如能在常温下反应检验的,就不用加热方法;能用物理方法检验出来的就不用化学方法);快速灵敏;简便易行。

3. 关于现象与结论
叙述时要注意:不能将待检物质当成已知物,叙述成某某物质有什么现象,而要先描述现象再得出结论,即有某某现象的物质是什么。

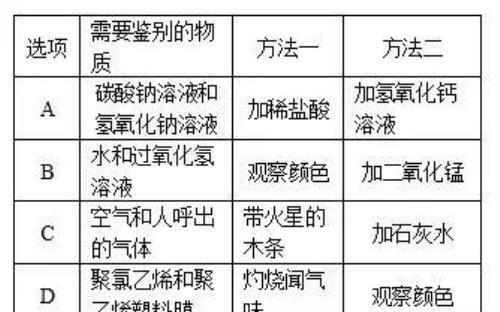
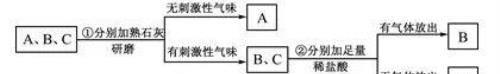
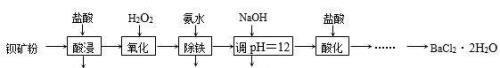
实训提升

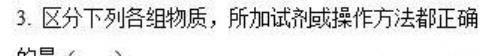












免责声明:本站部份内容由优秀作者和原创用户编辑投稿,本站仅提供存储服务,不拥有所有权,不承担法律责任。若涉嫌侵权/违法的,请与我联系,一经查实立刻删除内容。本文内容由快快网络小彤创作整理编辑!