> 汽车交通
化学方程式中溶质的计算(化学方程式的溶质怎么看)
导语:中考化学——根据反应化学方程式,计算溶质质量分数
化学是一门理科偏向文科的学科,在中考考察中主要有选择、实验、推断、计算等各种题型。这就需要我们在学习的过程熟记各种物质的化学特性、实验现象、物理性质等等。
小编根据自己上学的学习方法和思路通过网络文章的形式传递给大家,希望能够帮你们在中考的“战场”上多斩获一分。
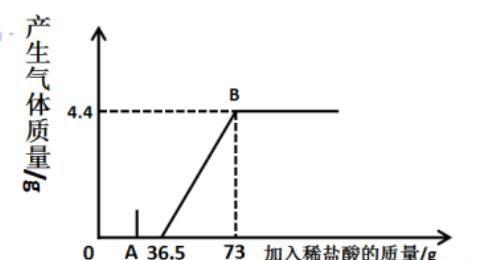
小秋在实验室发现一瓶未知浓度的碳酸钠的溶液,向165.4g的该溶液中逐滴滴加稀盐酸,发现没有立即产生气泡,查阅资料后发现,碳酸钠和少量的盐酸反应方程式如下:Na2CO3 + HCl= NaHCO3 + NaCl。
继续滴加稀盐酸至不再产生气体为止,产生的气体随着加入盐酸的质量变化如图所示。试回答下列各题:
(1)A点所对应溶质有
(2)加入盐酸的质量分数是
(3)计算B点溶液中的氯化钠的质量分数
题干解析:①在A点时,发生反应Na2CO3 + HCl= NaHCO3 + NaCl。溶液中Na2CO3 未完全反应,同时生成NaHCO3 和NaCl。所以此时溶液中的溶质有:Na2CO3、NaHCO3 和NaCl。
②题目中总反应过程中涉及以下两个反应:
Na2CO3 + HCl= NaHCO3 + NaCl (a)
NaHCO3+ HCl=NaCl+ CO2+ H2O (b)
所以a+b可得
Na2CO3 + 2HCl =2NaCl+ CO2+ H2O
由题可知,最终溶液的溶质为NaCl。根据质量守恒定律可知,氯化钠溶液的质量为=165.4g+73g-4.4g=234g
设:稀盐酸质量分数为x,则氯化氢质量为73x g;氯化钠溶液质量分数为y,则氯化钠质量为234y g。列方程式如下:
根据方程式解得x=10%,y=5%
答案详见解析本文内容由小珊整理编辑!