有机物化学式确定的算法是什么(有机物化学式确定的算法是)
导语:有机物化学式确定的算法
有机化学在高考中也占一部分分值
那么有机物分子式的确定有些方法
你知道吗?
下面就来说说有哪些方法。
️️️️️️️
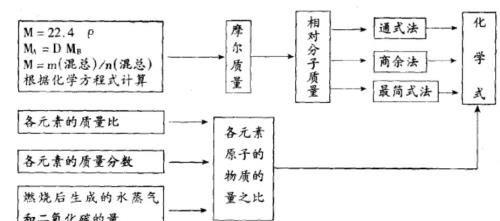
有机物化学式的确定1 确定有机物的式量的方法
①根据标准状况下气体的密度ρ,求算该气体的式量:M = 22.4ρ(标准状况)
②根据气体A对气体B的相对密度D,求算气体A的式量:MA = DMB
③求混合物的1平均式量:M = m(混总)/n(混总)
④根据化学反应方程式计算烃的式量。
⑤应用原子个数较少的元素的质量分数,在假设它们的个数为1、2、3时,求出式量。
2 确定化学式的方法
①根据式量和最简式确定有机物的分子式。(实验式法)
②根据式量,计算一个分子中各元素的原子个数,确定有机物的分子式。(直接法)
③当能够确定有机物的类别时。可以根据有机物的通式,求算n值,确定分子式。(通式法)
④据混合物的平均式量,推算混合物中有机物的分子式。(平均值法)
3 有机物分子式确定一般途径
4 有关烃的混合物计算的几条规律
①若平均式量小于26,则一定有CH4
②平均分子组成中,l < n(C) < 2,则一定有CH4。
③平均分子组成中,2 < n(H) < 4,则一定有C2H2。
有机物燃烧规律及其运用
1 物质的量一定的有机物燃烧
规律一:
等物质的量的烃CnHm和Cn-mH5m,完全燃烧耗氧量相同。 (n+m/4=n-m+m/4+m=n-m+5m/4)
规律二:
等物质的量的不同有机物CnHm、CnHm(CO2)x、CnHm(H2O)x、CnHm(CO2)x(H2O)y(其中变量x、y为正整数),完全燃烧耗氧量相同。
或者说,一定物质的量的由不同有机物CnHm、CnHm(CO2)x、CnHm(H2O)x、CnHm(CO2)x(H2O)y(其中变量x、y为正整数)组成的混合物,无论以何种比例混合,完全燃烧耗氧量相同,且等于同物质的量的任一组分的耗氧量。
符合上述组成的物质常见的有:
①相同碳原子数的单烯烃与饱和一元醇、炔烃与饱和一元醛。其组成分别为 CnH2n与CnH2n+2O即CnH2n(H2O);CnH2n-2与CnH2nO即CnH2n-2(H2O)。
②相同碳原子数的饱和一元羧酸或酯与饱和三元醇。 CnH2nO2即Cn-1H2n(CO2)、CnH2n-2O3即Cn-1H2n(CO2)(H2O)。
② 相同氢原子数的烷烃与饱和一元羧酸或酯 CnH2n+2与Cn+1H2n+2O2即CnH2n+2(CO2)
规律三:若等物质的量的不同有机物完全燃烧时生成的H2O的量相同,则氢原子数相同,符合通式CnHm(CO2)x(其中变量x为正整数);
若等物质的量的不同有机物完全燃烧时生成的CO2的量相同,则碳原子数相同,符合通式CnHm(H2O)x(其中变量x为正整数)。
2 质量一定的有机物燃烧规律一:
从C+O2=CO2、6H2+3O2=6H2O可知等质量的碳、氢燃烧,氢耗氧量是碳的3倍。可将CnHm→CHm/n,从而判断%m(H)或%m(C)。
推知:质量相同的烃(CnHm),m/n越大,则生成的CO2越少,生成的H2O越多,耗氧量越多。
规律二:质量相同的下列两种有机物CnHmOq与CnHm-16xOq+x完全燃烧生成CO2物质的量相同;质量相同的下列两种有机物CnHmOq与Cn-xHmOq+0.75x,燃烧生成H2O物质的量相同。
规律三:等质量的具有相同最简式的有机物完全燃烧时,耗氧量相同,生成的CO2和H2O的量也相同。
或者说,最简式相同的有机物无论以何种比例混合,只要总质量相同,耗氧量及生成的CO2和H2O的量均相同。
3 由烃燃烧前后气体的体积差推断烃的组成 当温度在100℃以上时,气态烃完全燃烧的化学方程式为: CnHm(g)+(n+m/4)O2==nCO2+(m/4)H2O
①△V > 0,m/4 > 1,m > 4。分子式中H原子数大于4的气态烃都符合。
②△V = 0,m/4 = 1,m = 4。、CH4,C2H4,C3H4,C4H4。
③△V < 0,m/4 < 1,m < 4。只有C2H2符合。
4 根据含氧烃的衍生物完全燃烧消耗O2的物质的量与生成CO2的物质的量之比,可推导有机物的可能结构
①若耗氧量与生成的CO2的物质的量相等时,有机物可表示为Cn(H2O)m
②若耗氧量大于生成的CO2的物质的量时,有机物可表示为(CxHy)n(H2O)m
③若耗氧量小于生成的CO2的物质的量时,有机物可表示为(CxOy)n(H2O)m (以上x y m n 均为正整数 )
希望这些对你们有帮助。️️
本文内容由小滢整理编辑!