高考化学原理题解题方法(高考化学原理综合题)
导语:高考化学——大题必考类型——化学原理习题集
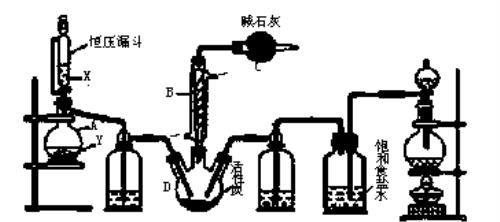
1.磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取少量的SO2Cl2,装置如下图所示(有些夹持装置省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈的水解反应,并产生白雾。
(1)单独检验己装置气密性的方法是:_______。
(2)由仪器B的使用可知SO2与Cl2反应的ΔH_______0(填">"或"<"),仪器C的作用是_______。
(3)试剂X、Y的组合最好是________。
a.18.4 mol/L H2SO4+Cu b.4 mol/L HNO3+Na2SO3 c.60% H2SO4+K2SO3
(4)反应结束后,将丙中产物分离的实验操作是_______。
(5)分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静止得到无色溶液w。
①写出该反应的离子方程式:________;
②检验溶液w中存在Cl-的方法是________。
(6)SO2Cl2可以作为锂离子电池的正极活性材质,已知电池反应为:2Li+SO2Cl2=2LiCl +SO2↑。则电池工作时,正极的电极反应式为_________。
【答案】 ⑴ 关闭分液漏斗活塞,将导管末端插入水中,加热烧瓶,导管口有气泡产生,停止加热,导管内形成一段高于液面的稳定水注,则气密性好
⑵ < 吸收尾气Cl2、SO2,防止环境污染,同时防止空气中的水蒸气进入引起磺酰氯水解 ⑶ c
⑷ 蒸馏
⑸① SO2Cl2+4OH-=2Cl-+SO42-+2H2O 取少量w于试管中,加入足量Ba(NO3)2溶液,静置,向上层清液加入硝酸酸化的AgNO3溶液,有白色沉淀生成,则w中存在Cl-
⑹ SO2Cl2+2e-=SO2↑+2Cl-
【题型】填空题
【难度】一般
2.实验室以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图:
(1) "酸浸"需要加热的目的是__________,此过程中发生反应的离子方程式是______________。(任写一条)
(2) "熔融"过程中,MnO2被KC1O3氧化成K2MnO4。
①该反应的化学方程式为_____________________。
②加入KC1O3应过量的原因除了提高MnO2利用率,还有_________________.
③将适量KClO3和KOH混合均匀后在坩埚内高温反应,应选用坩埚为__________。(选填序号)
a.石英坩埚 b.铁坩埚 c.氧化铝坩埚
(3)己知:①MnO42-只存在于强碱环境(pH>13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8;③相关物质的溶解度曲线如下图。
请补充完整由浸取液制备KMnO4晶体的实验方案:向浸取液中缓缓通入CO2,_____________,低温供干得KMnO4晶体。
【答案】 ⑴ 加快反应速率 FeO+2H+=Fe2++H2O; Fe2O3+6H+=2Fe3++3H2O; MgO+2H+ =Mg2++H2O;Al2O3+6H+=2Al3++3H2O;若写 2Fe2++4H++MnO2=Mn2++2Fe3++2H2O 等合理答案也给分。
⑵① 3MnO2+KC1O3+6KOH
3K2MnO4+KCl+3H2O ②KC1O3自身会分解 ③ b ⑶至pH≈12.3 (1分),过滤(1分),将滤液蒸发浓缩,冷却结晶,过滤,洗涤
【题型
】填空题
【难度】一般
3.氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行化学方法处理,可实现绿色环保、节能减
排、废物利用等目的。
(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-572 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mo
l-1
写出甲烷将NO2还原为N2并生成气态水时的热化学方程式________。
(2)工业上利用CO2生成甲醇燃料,反应为:
CO2(g)+3H2(g)
CH3
OH(g)+H2O(g) ΔH=-49.0 kJ·mo
l-1
将6 mol CO2和8 mol H2充入容器为2 L的密闭容器中,恒温下,H2的物质的量随时间变化如图1实线所示(图中字母后的数字表示对应坐标)。
①该反应在0 min~8 min内CO2的平均反应速率为________。
②仅改变某一条件再进行实验,测得H2物质的量变化如图1
虚线所示。与实线相比,曲线Ⅰ改变的条件可能是________,曲线Ⅱ改变的条件可能是________。
(3)反应:CO(g)+2H2(g)
CH3OH(g) ΔH=-129.0 kJ/mol可用于合成甲醇。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示。下列说法正确的是________(填字母)
A.温度:T1>T2>T3
B.正反应速率:ν(a)>ν(c)、 ν(b)>ν(d)
C.平衡常数:K(a)>K(c)、 K(b)=K(d)
D.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
(4)常温下,Ksp(BaCO3)=2.5×10-9,Ksp(BaSO4)=1.0×10-10,控制条件可实现如下沉淀转换:
BaSO4(s)+CO32-(aq)
BaCO3(s)+SO42-(aq)
该反应平衡常数K的表达式为:K=________,欲用1 L Na2CO3溶液将0.01 mol BaSO4全部转化为BaCO3,则Na2CO3溶液的最初浓度应不低于________。
【答案】 ⑴ CH4(g)+2NO2(g)=N2(g)+ CO2(g)+2H2O(g) ΔH=-866 kJ·mol-1 ⑵ ① 0.125 mol·L-1·min-1 ② 升温(或增大生成物浓度) 加压(或增大二氧化碳浓度) ⑶ CD
⑷
(若计算出结果0.04同样给分) 0.26 mol/L
【题型】填空题
【难度】一般
4.铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表中第____族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)6](NO3)2的名称是三硝酸六尿家合铁(Ⅲ),是一种重要的配合物。该化合物中Fe2+的核外电子排布式为_____,尿素分
子中C、N原子的杂化方式分别是____、____,其分子中σ键与π键的数目之比为____,所含非金属元素的电负性由大到小的顺序是____.
(3)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是________。
(4)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀.则第二种配合物的配体为____。
(5)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如右图所示,则该物质的化学式为______,若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为___pm (阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
【答案】 ⑴ Ⅷ 3
⑵ [Ar]3d5(或1s22s22p63s263d5) sp2 sp3 7∶1 O、N、C、H
⑶ 离子半径大小
⑷ SO42-、NH3
⑸ FeC
【题型】填空题
【难度】一般
5.某
些有机化合物之间具有如下转化关系:
其中A是一种五元环状化合物,其分子中只有一种化学环境的氢原子;F核磁共振氢谱显示有三种化学环境的氢原子,且峰面积之
比为2:2:3。
已
知:①
(其中R是烃基)
②R-COOH
R-CH2OH(其中R是烃基)
请回答下列问题:
(1)B中含氧官能团的名称是______,G是合成顺丁橡胶的主要原料,G的名称是_____,③的反应类型是________。
(2)写出A的结构筒式___
_________。
(3)写出⑥的化学方程式__________________。
(4)E在一定条件下能够发生缩聚反应,其中主链上含"-CH2-"的聚物的结构简式为_____。有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有____种。
【答案】⑴ 羧基 1,3-丁二烯 还原反应
⑵
⑶ HOOCCH2CH2COOH+2CH3CH2OH
CH3CH2OOCCH2CH2COOCH2CH3+2H2O ⑷
2
【题型】填空题
【难度】一般
本文内容由小涵整理编辑!