初中化学可燃物燃烧的条件(可燃物燃烧的化学方程式)
导语:关于《初三化学》考点知识“可燃物燃烧”疑难问题分析与探索
《初三化学》中关于“燃烧”的知识,是每年中考的难点和重点,它包括“燃烧、缓慢氧化反应、氧化反应、自燃”等相关知识。对于考生而言不仅仅要求了解“什么是燃烧、什么是氧化反应等”知识,而是要求掌握和理解它们的区别与联想。这样难度就很大,考试中失分也较多,下面就《中考化学大纲》中涉及到的“燃烧”的相关知识进行分析与探讨。
1、燃烧与氧化反应的联系与区别
(1)什么是燃烧反应?
人类的生存需要大量的能量,这些能量的提供离不开燃烧反应,所以燃烧的重要性不言而喻。在平时的日常生活中,经常会见到形形色色的燃烧现象。比如居民做饭的柴火或燃气燃烧;也有冶金工业中的焦炭燃烧;也有航天领域火箭发射过程中燃料的燃烧等。作为中考学生来说,不仅要认识什么是燃烧,还有掌握燃烧的概念及其相关知识点。首先要清楚什么是燃烧反应?燃烧是可燃物与氧气充分接触,在一定条件下,发生的一种伴有发光、发热的剧烈的氧化反应。燃烧与其它化学反应不同,燃烧反应的特点明显:发光、产生大量的热、属于氧化反应类型。这种反应发生的条件比较复杂,必须同时满足可燃物、氧气、温度达到着火点三个条件。
(2)什么是氧化反应?
氧化反应是一种特殊的化学反应,它不属于初中阶段学习的“四种基本反应类型”(四种基本反应类型:化合反应、分解反应、置换反应、复分解反应)中的某一种反应。氧化反应与它们之间没有明显的界限,除复分解反应外,其余三种反应都有可能是氧化反应。氧化反应是指物质与“氧”发生的反应,这里的“氧”可以是氧气、也可以是氧元素、还可以是元素的氧化性。也就通常所说的,氧化反应可以从“得氧失氧、化合价升降、得失电子”三个不同的角度去分析某一反应是否为氧化反应。然而对于初中阶段的学生,只有要求掌握从“得失氧”的角度能够正确分析氧化反应。
(3)燃烧与氧化反应的区别与联系
根据燃烧的定义,可知道燃烧是一种氧化反应,一种剧烈的氧化反应。换而言之,燃烧反应中一定有氧气参加,所以燃烧一定是氧化反应。其实氧化反应是无法单独存在,有物质发生氧化反应,同时一定有物质发生还原反应。也就是说氧化反应与还原反应是同时存在在于一个反应中,无法分割的两个反应。初中阶段的“氧化反应”实际上就是氧化还原反应。
根据对燃烧概念的分析,可知所有的燃烧都是氧化反应,但是氧化反应不一定是燃烧。比如一氧化碳还原氧化铜的反应,是氧化反应(当然也包含还原反应),但是它却不是燃烧,像这样的反应还有很多。
2、燃烧与缓慢氧化反应的区别与联系,
常见的化学反应中,氧化反应较多,比如各种物质的燃烧以及冶金工业中炼钢炼铁等都属于氧化反应。这些氧化反应之间,既有联系,也有区别。下面就中考中关于氧化反应中的燃烧与缓慢氧化反应之间的联系与区别进行分析。
(1)什么是缓慢氧化反应?
缓慢氧化反应是一种特殊的氧化反应,是与燃烧相对的氧化反应。那么什么是缓慢氧化反应呢?缓慢氧化反应就是物质与氧气发生的一种不易让人觉察到的反应。比如人和动物的呼吸、铁生锈、饭菜变质等变化都属于缓慢缓慢氧化反应。我们生活中,时刻都有缓慢氧化反应发生,只是它们反应时产热不多、现象不明显而已,无法让人感觉到反应的发生。
(2)燃烧与缓慢氧化反应的区别与联系
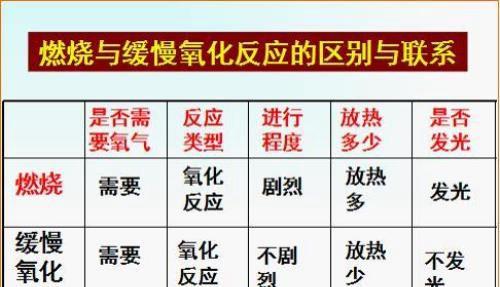
燃烧与缓慢氧化反应都属于氧化反应,是物质与氧气发生的反应。在反应类型上是相同的,而且反应物中都有氧气。即两者的相同点:有氧气参加、有热量放出、氧化反应。但是燃烧与缓慢氧化反应也有着本质的区别,那就是它们反应的现象不同,主要表现在燃烧:发光、放热快且多、剧烈;缓慢氧化反应:不发光、放热慢少、缓慢难以觉察。燃烧不可能转化为缓慢氧化反应,但是缓慢氧化反应进行到一定的程度可以发展为燃烧,这就是化学中的“自燃”现象。自燃是指可燃物由于缓慢氧化反应而引发的燃烧,是不需要直接“点火”,或加热就能够发生的燃烧,主要是那些着火点较低的物质容易引发自燃。
3、有哪些方法措施可以防止可燃物由缓慢氧化反应引发自燃。
前面讲到燃烧与缓慢氧化反应之间有区别,更有联系。如果可燃物堆放不当,长期处于潮湿的环境中,就会出现腐烂。其实物质的腐烂变化就是一个复杂的缓慢氧化反应过程,如果反应产生的热量不能够及时散失,热量就会越来越多,可燃物的温度也会随之升高,当温度升高至可燃物的着火点时,就会出现自燃。所以平时在堆放可燃物的时候,一定要防止发生自燃现象,具体可以采取下面措施。
(1)堆放可燃物的场所一定要通风,让产生的热量及时散失。
(2)堆放可燃物的场所一定要保持干燥,防止可燃物腐烂,发生缓慢氧化反应,而引发自燃。
(3)堆放可燃物的场所一定要远离火源。
(4)堆放太久的可燃物一定要定期翻动,主要是防止中间的可燃物发生腐烂(缓慢氧化反应)产生的热量无法散失。如果发生了缓慢氧化反应,经常翻动可以使产生的热量及时散失,避免出现自燃。
4、为什么可燃物在空气中与氧气中燃烧的现象不同
影响可燃物燃烧剧烈程度的因素主要有两种,即内因和外因。内因就是可燃物本身的性质,是由可燃物的结构决定。比如汽油燃烧比木材燃烧更剧烈,纸张燃烧比木炭燃烧剧烈等。也是就说可燃物本身的性质不同,燃烧的剧烈程度也不相同。外因就是氧气的浓度以及可燃物与氧气的接触面积大小。氧气浓度越大,燃烧越剧烈;与氧气接触面积越大燃烧越剧烈。
(1)硫在空气中与氧气中燃烧产生的现象不同
单质硫是一种淡黄色的固体粉末,能够与氧气在点燃的条件下发生燃烧反应。当将相同质量和形状大小的硫单质分别在空气中和纯净的氧气中燃烧,因为参加反应的氧气的浓度不同,它们的燃烧反应剧烈程度也不相同。因为空气中氧气的浓度比纯净氧气中氧气的浓度小很多,所以其燃烧反应现象也不相同。
【空气】现象:火焰-微弱的淡蓝色,产生热,产物-有刺激性气味的气体。
【氧气】现象:火焰-明亮的蓝紫色,产生热,产物-有刺激性气味的气体。
(2)铁丝在空气中与氧气中反应产生的现象不同
细铁丝在空气不能够燃烧,主要是因为空气中氧气的浓度不高。在空气中加热细铁丝,铁丝会呈红热状态,与氧气发生氧化反应,只是反应不会很剧烈。然而,细铁丝却能够在纯净的氧气中燃烧,现象很剧烈,如下图所示。
【空气】现象:铁丝红热,产生热,产物-黑色固体。
【氧气】现象:火星四射,产生热,产物-黑色固体。
根据以上分析可以得出,对于同一种可以与氧气发生反应的物质而言,在氧气浓度不同的环境中,如果升高温度,大部分可以发生氧化反应,氧化产物基本相同。但是除炭与氧气反应外,氧气浓度不同时,不仅反应现象不同,而且最终生成的产物也不相同。氧气浓度较大的情况下,碳会充分燃烧,产物为二氧化碳氧气;氧气浓度较低时,碳与氧气反应不完全,产物为一氧化碳。
但是对大部分物质而言,氧气浓度不同时,只会影响反应的现象,不会影响反应产物。一般氧气浓度越大,反应现象越剧烈;氧气浓度越低,反应现象就越微弱,甚至无法发生燃烧反应。比如铁丝在空气中加热,就不会燃烧,但是会发生氧化反应。
对于初三考生来说,不仅要掌握“燃烧、氧化反应、缓慢氧化反应、自燃”等相关的概念,更要能够理解它们之间的联系与区别。希望通过以上分析对广大考生理解燃烧概念有所帮助。
本文内容由小梓整理编辑!