八隅规则怎么读(八隅律是什么)
导语:什么是八隅规则(八电子规则)?
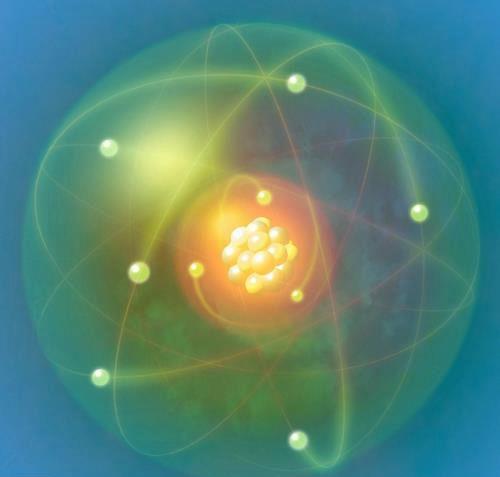
八隅规则(或称八电子规则)指出,原子倾向于在其价壳层中具有 8 个电子,以便拥有类似于最接近惰性气体的电子结构。
八隅规则是化学&34;之一,指出原子喜欢以这样的方式组合,以至于每个原子的价壳层中都有8个电子。价壳是原子的外壳,外壳中的八个电子允许原子具有类似于最接近惰性气体的配置,这反过来又使它们更加稳定。
为了在价壳层中具有8个电子,原子倾向于形成共价或离子键。离子键见氯化钠或盐,而共价键见二氧化碳(CO2)。键由原子形成,以减少反应,享受更多的稳定性。
为了理解原子如何以及为什么在价壳层中需要8个电子才能处于稳定状态,让我们首先了解电子在原子中的分布方式。
电子是如何在原子中分布的?原子是元素中最小的粒子,然而,它内部却有一个微观宇宙。构成这个微观宇宙一部分的3个亚原子粒子是中子、质子和电子。中子没有净电荷,位于原子的中心,以及带正电荷的质子。中子和质子一起构成原子核。电子是负电荷粒子,绕着原子核旋转。
电子和质子被电磁力相互吸引,电磁力是带电粒子之间的物理相互作用。因此,将电子与原子核分离需要大量的能量。电子离原子核越近,分离它所需的能量就越高。
电子在名为K、L、M和N的不同壳中旋转,从原子核开始向外扩展。每个逐行壳具有不同的能量级别,对应于 1、2、3 或 4。每个外壳可以包含的最大电子数为 2(n^2),其中 n 对应于能级。因此,K有2个电子[2(1)^2],L有8个电子,M有18个电子,N有32个电子。
电子层或电子壳
此外,这些壳被分为含有原子轨道的子壳。壳包含从原子核开始的轨道,名为s、p、d和f。电子在壳和子壳中的排列称为原子的电子配置。
外壳的数量会根据原子中存在的电子数量而增加。元素中最外层的外壳称为价壳层,而发现的电子称为价电子。
什么是价壳层?价电子导致原子参与化学反应的倾向。一个装有封闭外壳的原子,其价壳层中含有8个电子,被认为具有化学惰性,因为它几乎不参与化学反应。然后,这些元素的原子将具有类似于惰性气体的电子结构。周期表是一个表格排列,包含按其电子配置、性质和原子数排列的所有已知元素。在表格的最右边是称为惰性气体的元素组。它们被认为是稳定的元素,因为它们有一个完全填充的价壳层。这6种惰性气体是氦(2)、氖(10)、氩(18)、氪(36)、氙(54)和放射性元素氡(86),每个括号内的数值表示元素的原子序数。
惰性气体是反应最少的,因为它们的外能级已经充满。8个电子在其外壳的存在使惰性气体的价值为零。其他反应原子往往通过遵循八隅规则来填充其外壳,以接近惰性气体的稳定性。
惰性气体
八隅规则只考虑 s 和 p 子壳中存在的电子。这些子壳可以容纳最多8个电子在其最外层的外壳。你可以认为价电子是原子拥有的一些最重要的电子,因为它们是位于最高能量水平的电子。这些是最常见的参与化学反应的电子。可以使用刘易斯电子点结构计算价电子。
什么是刘易斯电子点结构(LEDS)?刘易斯的结构以吉尔伯特·刘易斯的名字命名,他于1916年首次在他的文章《原子与分子》中引入了这个概念。刘易斯结构只代表价电子,这些电子被标识为原子周围的点,每个点代表一个价电子。大多数时候,其价壳中电子少于8个的原子倾向于通过共价键或离子键形成化合物。
这种键的形成可以满足八隅规则。周期表第二组的元素通过在原子之间丢失、获得或共享电子来满足8个电子的标准。
形成的键的类型取决于价壳中的电子数量,以及形成该键所需的总能量。LEDS 帮助我们确定有多少自由电子可用于化学反应。
什么是共价键?共价键是两个原子之间的连接,允许它们之间共享电子,这样每个原子都有类似于最接近惰性气体的电子结构。
以二氧化碳为例:碳和氧的原子序数分别为6和8。碳有2个壳,K和L,在K壳中有2个电子,在L壳中留下4个电子。为了达到稳定性,碳要么会失去所有4个电子,最接近氦气,要么获得4个电子,最接近氖。由于质子和原子核中电子之间的吸引力,获得或失去4个电子所需的能量是巨大的。然而,中间地带的选择是共享其电子。
同样,氧气在K壳中有2个电子,在L壳中有6个电子。它只需要2个电子是稳定的,并达到类似于氖的电子配置。获得2个电子比失去4个电子更容易(这将使它类似于氦)。作为调整,2个氧原子喜欢用一个碳原子共享其电子,这样所有三个原子的价壳中都有8个电子,并且各自稳定。
显示 CO2 的刘易斯点结构。x代表碳的电子,点代表氧电子。
其结果是形成一个具有一个碳原子和2个氧原子的二氧化碳分子,每个原子在它们的价壳层种各自具有8个电子。
什么是离子键?离子键是一种发生在相反电荷离子之间的化学键。原子可以是正电荷,也可以是负电荷,这取决于原子过量的质子或电子的数量。由于电子的增益或损耗,电子是具有净电荷的原子。请记住,电子带负电荷,如果一个原子获得一个电子,它将有负电荷,但如果它失去了一个电子,它将有一个正电荷。简而言之,电子是包含特定电荷的原子。
金属与非金属之间发生离子键,其中一种是电正的,另一种是电负的。电正金属失去电子,变成正离子,称为阳离子,而电负非金属接受电子,成为负电荷离子,称为阴离子。电子的损耗和接受是相同的,以形成离子键,同时,每个原子满足八隅规则!
阳离子与阴离子
因此,当一个原子的电子和质子数量不等时,它被称为一个离子。结果,2个电荷不相等的原子通过失去或获得电子而走到一起,从而通过离子键达到中性电荷。它们借助于它们之间的吸引力保持键合。最终的结果是每个原子都是稳定的,因为它有一个完全充满8个电子的价壳层。
盐或氯化钠是离子键的一个很好的例子。钠的原子数为11,K、L和M壳中分别有2、8和1个电子。这在价壳中留下1个电子,钠原子在反应中很容易丢失。氯的原子数为17,K、L和M壳中为2、8和7电子。氯的价壳有7个电子,因此具有很强的电负。每个原子只需要调整1个电子,有一个完全填充的价壳层,并达到一个类似于最接近惰性气体的配置。
氯化钠(盐)中的离子键合
在钠或氯的情况下,获得或失去7个电子所需的能量是巨大的。为了使这个过程更容易,钠失去了它孤独的电子,并获取了类似于氖(10)的电子配置。氯接受钠丢失的电子,并实现类似于氩(18)的电子配置。最终结果是钠和氯之间的离子键,形成稳定的化合物,也就是我们日常吃的盐。
我敢打赌,你从来没有想过,日常的食盐竟然有如此复杂的化学经历!
八隅规则的例外情况是什么?有一些元素不遵循八隅规则的示例,让我们简单看一下它们。
电子奇数的分子通常不遵循八位字节规则。此外,只有2个电子(总数)的原子属于这一类。原子序数为1的氢原子最多可以容纳2个电子,但这些原子只有一个带s轨道的电子外壳。由于八隅规则仅适用于 s 和 p 轨道,因此具有 2 个电子的原子是该规则的例外。另外,一个或多个原子具有多或少于8个电子的分子也是例外。
八隅规则是化学中最重要的规则之一,它控制原子如何相互作用以在其价壳层种容纳8个电子,形成共价键或离子键是原子满足八隅规则的最方便的方法。毕竟,原子可能厌倦了一直处于反应状态,而遵循八隅规则只是为了获得稳定!
本文内容由小涵整理编辑!