为什么你总是做不好戚风蛋糕(为什么我总是做不好事)
导语:为什么你总是做不好SDS-PAGE?
1.装板
将密封用硅胶框放在平玻璃上,然后将凹型玻璃与平玻璃重叠,将两块玻璃立起来使底端接触桌面,用手将两块玻璃夹住放入电泳槽内,然后插入斜插板到适中程度, 即可灌胶。
2. 凝胶的聚合
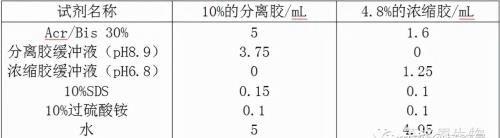
分离胶和浓缩胶的制备:按下表中溶液的顺序及比例,配置10%的分离胶和4.8%的浓缩胶。
按上表各液加入混匀后配制成分离胶后,将凝胶液沿凝胶腔的长玻璃板的内面缓缓用滴管滴入,小心不要产生气泡。将胶液加到距短玻璃板上沿2cm处为止,约5mL。然后用细滴管或注射器仔细注入少量水,约0.5-1mL。室温放置聚合30-40min。
待分离胶聚合后,用滤纸条轻轻吸去分离胶表面的水分,按上表制备浓缩胶。用长滴管小心加到分离胶的上面,插入样品模子(梳子);待浓缩胶聚合后,小心拔出样品模子。
3.蛋白质样品的处理
若标准蛋白质或欲分离的蛋白质样品是固体,称取lmg的样品溶解于lmL 0.5mol/L pH6.8Tris-盐酸缓冲液或蒸馏水中;若样品是液体,要测定蛋白质浓度,按1.0~1.5mg/mL溶液比例,取蛋白质样液与样品处理液等体积混匀。本实验所用样品为15~20mg的标准蛋白样品溶液,放置在0.5mL的离心管中,加入15—20ml的样品处理液。在100℃水浴中处理2min,冷却至室温后备用。
吸取未知分子量的蛋白质样品20ml,按照标准蛋白的处理方法进行处理。
4.加样
SDS-聚丙烯酰胺凝胶垂直板型电泳的加样方法:
用手夹住两块玻璃板,上提斜插板使其松开,然后取下玻璃胶室去掉密封用硅胶框,注意在上述过程中手始终给玻璃胶室一个夹紧力,再将玻璃胶室凹面朝里置入电泳槽,插入斜板,将缓冲液加至内槽玻璃凹面以上,外槽缓冲液加到距平板玻璃上沿3mm处即可,注意避免在电泳槽内出现气泡。
加样时可用加样器斜靠在提手边缘的凹槽内,以准确定位加样位置,或用微量注射器依次在各样品槽内加样,各加10~15ml(含蛋白质10~15mg),稀溶液可加20~30ml (还要根据胶的厚度灵活掌握)。
5.电泳
加样完毕,盖好上盖,连接电泳仪,打开电泳仪开关后,样品进胶前电流控制在15~20mA,大约15~20min;样品中的溴酚蓝指示剂到达分离胶之后,电流升到30~45mA,电泳过程保持电流稳定。当溴酚蓝指示剂迁移到距前沿1~2cm处即停止电泳,约1-2小时。如室温高,打开电泳槽循环水,降低电泳温度。
6.染色、脱色
电泳结束后,关掉电源,取出玻璃板,在长短两块玻璃板下角空隙内,用刀轻轻撬动,即将胶面与一块玻璃板分开,然后轻轻将胶片托起,指示剂区带中心插入铜丝作为标志,放入大培养皿中染色,使用0.25%的考马斯亮蓝染液,染色2~4h,必要时可过夜。
弃去染色液,用蒸馏水把胶面漂洗几次,然后加入脱色液,进行扩散脱色,经常换脱色液,直至蛋白质带清晰为止。
7.结果处理
1)测量脱色后凝胶板的长度和每个蛋白质样品移动距离(即蛋白质带中心到加样孔的距离),测量指示染料迁移的距离。
2)按以下公式计算蛋白质样品的相对迁移率(Rm)
相对迁移率=样品迁移距离(cm)/染料迁移距离(cm)
3)标准曲线的制作:以各标准蛋白质相对迁移率为横坐标,蛋白质分子量的对数为纵坐标在半对数坐标纸上做图,得到一条标准曲线。
4)测定蛋白质样品的分子量:根据待测蛋白质样品的相对迁移率,从标准曲线上查得该蛋白质的分子量。
本文内容由小德整理编辑!