亲电加成反应活性大小怎么判断(亲电加成反应活性顺序怎么比较)
导语:亲电加成反应(1)
前情回顾:
有机化学反应绝大部分其实都是Lewis酸和Lewis碱的中和反应,电子从富电子的地方流入缺电子的地方。
第一次接触亲电加成不出意外的话是在学烯烃的时候吧~
首先,亲电和亲核是相对的同时存在的,氢质子去结合π电子,那就是亲电的过程,如果反过来,π电子去结合氢质子,那就是一个亲核的过程(虽然我们好像从来都没有这么说过[doge])
烯烃和不同的试剂发生亲电加成的时候,可以按照“碳正离子中间体机理”,“环正离子中间体机理”,“离子对中间体机理”和“三中心过渡态机理”进行。
不用慌,咱们一个个来看。
本期先来看一下“碳正离子中间体机理”
代表是烯烃和氢卤酸的反应。
再简化一下,就先看乙烯和HCl反应。
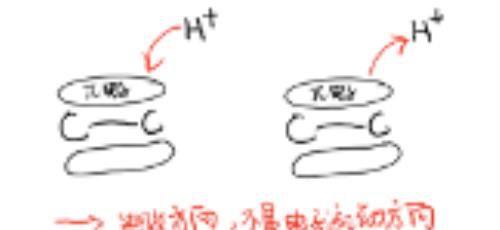
首先对于一个乙烯来说,π电子就均匀的分布在两侧。
当烯烃周围出现了HCl异裂得到的氢质子的时候,π电子就会朝氢质子移动,毕竟正负电荷相吸,飞蛾扑火,此时π电子云会发生一定程度的变形,然后当这个π电子云和氢质子的s空轨道重叠之后,就会形成一个C-Hσ键。
本来两个电子属于两个碳共有的,此时只属于其中一个碳,另外一个碳就没有电子了,从而会剩下一个空的p轨道,带正电。我们叫它“碳正离子”。
然后呢,当这个碳正离子周围有氯离子的时候呢,氯的最外层电子受到碳正离子的吸引也会发生变形,接着和碳正离子的空的p轨道重叠从而形成C-Clσ键。
由于在这个反应中形成了碳正离子这样的中间体,所以我们称这种机理为“碳正离子中间体机理”。不难吧?
接下来,稍微复杂一点,丙烯和HCl加成产物怎么办?
不用慌,当乙烯连有一个甲基的时候呢,由于甲基的碳sp3杂化,双键碳sp2杂化,电负性sp2大于sp3,所以甲基给电子,+I的诱导效应。会导致双键π电子云远离甲基,也就是在没有氢质子的条件下π电子已经提前发生了移动。
为了简化,不画电子云,我们可以标出每个碳所带的电性。
此时如果周围有氢质子,肯定会和带有δ-的1号碳形成C-Hσ键。氯离子和带有δ+的2号碳形成C-Clσ键。
看到这里,各位小伙伴想起什么了嘛?
对,马氏规则,氢加在氢多的碳上。
那,那如果把-CH3换成-CF3呢?
应该可以很容易地预想到下面的情形。
所以和HCl的加成刚好相反,即得到反马氏加成产物。
我们前面提到过,不同的碳正离子稳定性有点区别。
这和亲电加成有什么关系吗?
有!关系很大。
举个例子,当我们用下面这个烯烃和HCl反应的时候,按理说我们可以得到双键加成的产物。
但是实验就打脸了,我们得到了另外一个化合物。
仔细观察一下,前面Cl连在的是一个二级碳上,而下面的这个连在了一个三级碳上。
How??
这就要说到碳正离子的重排了~
因为C-CH3的σ键轨道转到某个角度的时候呢可以和碳正离子的p轨道发生重叠,然后甲基就带着一对电子叛变跑去和碳正离子成键了。留下了一个三级的碳正离子等待和氯离子成键。
再稍微变那么一点点。
这个反应的产物得到啥?
给你们5秒钟思考时间。
5
4
3
2
1
答案是C。
嘿嘿,氢带着一对电子叛变了~
本期先到这里~
未完待续~
参考资料:
1. 邢其毅,裴伟伟,徐瑞秋,裴坚。基础有机化学(第四版),高等教育出版社。
感谢各位小伙伴关注,点赞,分享~
本文内容由小涵整理编辑!