> 自然
原子构成的规律有哪些(原子构成的规律五条)
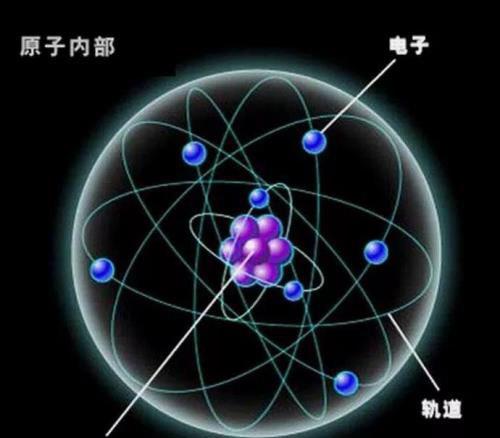
导语:原子构成的规律
同学们我们已经知道原子是由:质子,中子,核外电子三部分构成。原子核结构包含:质子和中子两部分。
以前我们学习了元素周期表中的1到20号元素的名称,符号,以及它们的背诵顺序。这里就可以用了1号元素的序号就是1,6号元素的序号就是6,15号元素的序号就是15,20号元素的序号就是20依次推下去。那么这个元素序号拿来干嘛呢?
1号元素的:质子数就是1,
8号元素的:质子数就是8,
6号元素的:质子数就是6,
17号元素的:质子数就是17,说白了同学们只要记住元素符号的序号就知道了它的质子数。
那么知道质子数有什么用呢?
当我们知道质子数后,就可以知道它的核外电子数。为什么呢?因为大家知道质子是带正电的,核外电子是带负电的,而中子是不带电的,整个原子也是不带电的。所以啊质子带的正电和核外电子带的负电,电量是相等的,电性是相反的。
而原子核所带的电是由质子决定的,原子核带的电荷数我们称之为:核电荷数。中子不带电和它没有关系。
中子数就不一定了,它可能等于质子数,也可能不等于质子数。
而且化学元素周期表表中有一种元素它的原子不带中子,它就是1号元素氢元素它的原子就没有中子特殊情况。
总结一下:在原子中有几个是相等的。
质子数=核外电子数=核电荷数=原子序数
本文内容由小岑整理编辑!