三段式解化学平衡问题(化学平衡常数三段式法)

这节课是一节习题课,我们要一起来学习化学平衡常数。

第一题,关于化学平衡常数,下列哪一个说法是错误的?

化学平衡常数不随着反应物或者是生成物的浓度的改变而改变,A是正确的。我们知道化学平衡常数它只有一个影响因素,那就是温度。b选项,对于一个一定温度下的同一反应,它的正反应和逆反应的化学平衡常数的乘积等于一,这是正确的,因为正反应和逆反的平衡常数就是互为倒数的,这也是一个很重要的推论。
请大家记住c选项化学平衡常数越大,证明着可逆反应正向进行的程度会越大。也可能是吸热的,也可能是放热的。这个题呢,我们会在后面的课程当中为大家详细的解析。放在这里有一点早,c选项是错误的,这时候我们要看反应是一个放热的过程还是吸热的过程。d选项化学平衡常数只受温度影响,和反应物的浓度、体系的压强等等都没有关系,因此第一题正确选项是c。
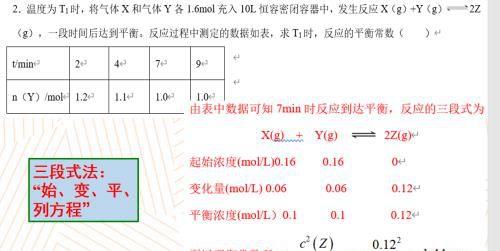
第二题,在一定的温度下,把气体x和气体y冲入到了十升的恒隆密闭容器中,发生了一定的反应,一段时间后达到平衡,测定各种物质的数据如下表所示,让我们来求平衡常数。请大家和我一起来复习三段式法,三段式指代的是将方程式写出,然后标注出起始的浓度、变化的量以及平衡的浓度,那我们将各个数据摆出来,然后再带入到平衡常数的表达式当中,最后即可以算出答案。这里请大家关注,平常数k的表达式一定只能带浓度,如果题目当中给出的是物质的量,那我们优先要用物质的量除以容器的体积,才能够得到某一种物质的物质的量、浓度。

第三题,让我们来书写这个反应的平衡常数表达式。请大家观察,固态或者是纯液态的物质是不可以写入平衡常数表达式的,因此在这个方程式当中,我们只需要把二氧化碳和一氧化碳表示出来即可。那下面的计算也是很简单的,利用q和k之间的关系去判断反应是否达到平衡状态。如果没有达到平衡状态,那就再进行对比q和k的大小,若q小于k的时候,说明平衡是正向进行的,反应没有达到平衡,此刻正反应的速率会大于逆反应的速率。因此第三题是一个很典型的,既考察平衡常数的书写,又考察平衡状态的判定,还能够让大家去比较中逆反应的速率是一道很典型的例题。
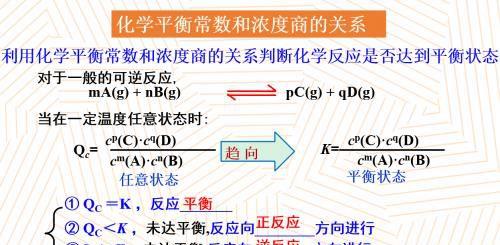
在这里我们也复习一下上节课学到的知识,化学平衡常数和浓度之间的关系,q指的是任意状态的,而它会无限地趋向于平衡状态,当两者相等的时候,反应达到了一个平衡,如果q小于k,那说明没有达到平衡,反应正向进行,反之亦然。
以上就是今天的全部内容,如果有疑问可以在下方留言,也欢迎大家积极转发。
免责声明:本站部份内容由优秀作者和原创用户编辑投稿,本站仅提供存储服务,不拥有所有权,不承担法律责任。若涉嫌侵权/违法的,请与我联系,一经查实立刻删除内容。本文内容由快快网络小鸣创作整理编辑!