氧化还原反应方程式的书写方法(氧化还原反应方程式总结)
氧化还原反应方程式的书写
氧化还原反应方程式的书写基础是常见的氧化剂(还原剂)其对应产物需要熟悉,核心是配平,书写时以离子反应较为简单。
1书写方法:
以向酸性KMnO4溶液中通入SO2为例:
(1)找出氧化剂和还原剂:氧化剂——MnO4-;还原剂——SO2
(2)根据氧化剂和还原剂写出相应的氧化产物与还原产物:氧化产物——Mn2+;还原产物——SO42-;
(3)写出相应的反应,根据化合价升降相等对参与氧化还原反应的物质进行配平(见2氧化还原反应的配平):
2MnO4- + 5SO2 → 2 Mn2+ + 5SO42-
(4)观察其他未参与氧化还原的元素,确定所缺失的元素,多退少补:左边18个O,右边20个O,故左边缺2个O。
(5)从反应体系中寻找含有所缺失元素的物质:反应体系中其他含有O的物质为H2O或OH-,又反应体系为酸性,故选择H2O,左边加上2个H2O。
【注意】缺项配平中所缺失的物质一般为H2O、OH-或H+,需要根据反应体系选取合适的物质,但是不一定酸性体系就补H+,碱性体系就补OH-,得根据实际所缺失的元素来选择。
(6)补全方程式:左边补上2个H2O后,左边多出4个H+,在右边加上4个H+
2MnO4- + 5SO2 + 2H2O→ 2 Mn2+ + 5SO42-+ 4H+
2氧化还原反应的配平:
(1)氧化还原反应的配平依据:
a、化合价升降规律:氧化剂得电子总数跟还原剂失电子总数必相等,表现在化合价上就有被氧化元素化合价升高的价数必定跟被还原元素化合价降低的价数必定相等。
b、质量守恒定律:任何化学反应前后,各元素原子个数必定守恒。
c、电荷守恒定律:反应物和生成物所带的电荷总量一定相等。
(2)配平的一般步骤:
a、找出反应前后化合价发生变化的元素;
b、分析各变价元素的化合价升、降的价数;
c、以化学式为单位,求出化合价升、降价数的最小公倍数,使有关元素的化合价升、降总价数相等。
d、用观察法配平其它元素的化学计量数。
【例1】配平下列方程式
标价态:观察分析并标出发生氧化反应和还原反应的各元素反应前后的化合价。
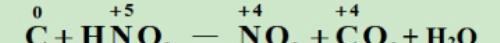
列变化:用双线桥标出反应前后元素化合价的变化情况。
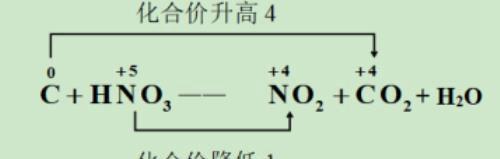
令相等,配计量数:找它们的最小公倍数,这样就可使化合价升高和降低的总数相等。

观察配平,单线变等号:
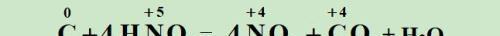
【注意】有时候,对于氧化还原反应中的反应物来说,只有一部分参加了氧化还原反应,此时,应先用化合价升降法确定氧化剂或还原剂的化学计量数,然后再将没有参加氧化还原反应的原子(或原子团)数加到有关氧化剂或还原剂的化学计量数上,如下:
【例2】配平铜与稀硝酸反应的化学方程式
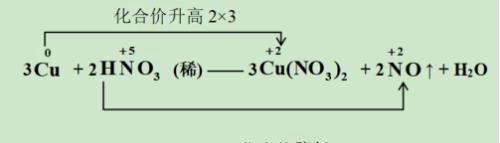
在上述反应里,3个Cu(NO3)2 中的6个NO3—并没有参与氧化还原反应,所以应在2个HNO3的基础上加上6个,即HNO3的化学计量数应为8,由此也可知H2O的化学计量数应该为4。故最终方程为:
3Cu + 8HNO3 (稀) =3Cu(NO3)2 + 2NO↑ + 4H2O
免责声明:本站部份内容由优秀作者和原创用户编辑投稿,本站仅提供存储服务,不拥有所有权,不承担法律责任。若涉嫌侵权/违法的,请与我联系,一经查实立刻删除内容。本文内容由快快网络小春创作整理编辑!