移植的胚胎是嵌合体,是继续移植还是丢弃?
辅助生殖领域中,胚胎植入前遗传学筛查(PGS)已广泛应用于筛查整倍体胚胎,改善妊娠结局。近年,随着细胞遗传学方法的改进,可以对单细胞进行全染色体的筛查,因此,嵌合体胚胎的诊断率提高。但是,关于嵌合体胚胎的文献报道较少,本文就嵌合体胚胎的发生机制、发生率,以及移植后临床结局做一综述。
一、嵌合体胚胎的发生机制
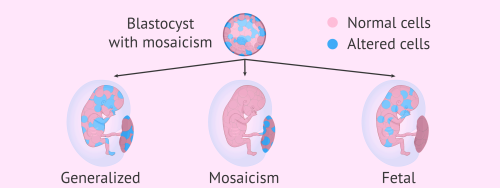
嵌合体胚胎包含两种及以上不同染色体成分的细胞系,是因减数分裂中染色体分离错误所致。在两细胞期就可以出现嵌合体,但是临床上多见于在囊胚期进行滋养外胚层细胞活检,因为在这一时期可以活检的细胞数更多。滋养外胚层细胞活检是否能代表整个胚胎受诸多因素影响,例如嵌合的类型和程度、活检细胞数量、活检部位,以及操作方法等。
种植前遗传学诊断国际协会(PGDIS)规定异常细胞占比20%~80%为嵌合体胚胎,>80%为非整倍体胚胎,<20%为整倍体胚胎。染色体嵌合导致染色体增加和/或丢失主要有三种机制:染色体不分离、后期延迟和核内复制。
1.染色体不分离:染色体不分离是姐妹染色单体在有丝分裂过程中没有分离。因此整个染色体(包括两条染色单体)被牵引到一个细胞内,导致一个细胞是单体性而另一个细胞是三体性。如果不分离发生在细胞分化之前,例如在种植前的胚胎,将形成普遍嵌合。如果不分离发生在分化之后,例如滋养层,胎盘将包含嵌合细胞系,而胚胎可以是整倍体。
种植前染色体不分离的概率无统一结论,主要与发育的阶段和涉及的染色体有关。例如,导致常染色体第一次和第二次减数分裂形成非整倍体的机制和染色体不分离的可能性最小,但是染色体不分离却是性染色体在第一次卵裂期分裂中的主要机制。因此,染色体在不同发育阶段对不分离的敏感性不同。
2.后期延迟:后期延迟是有丝分裂后期,单个染色单体没有进入子代细胞核随后丢失,导致一个细胞里该染色体是单体性而另一个细胞里是二体性。如果染色单体没有附着于纺锤体,或者染色单体虽然附着于纺锤体但是后来没有进入细胞核,即为后期延迟。如果后期延迟发生在分化前,将包含两种细胞系,导致普遍嵌合。如果后期延迟发生在分化后的滋养层细胞,胎盘将包含正常和单体性细胞系,例如限制性胎盘嵌合体(confined placental mosaicism,CPM)。
Loannou 等利用丢弃的第5天的胚胎进行检测,发现单体性发生率是三体性的7倍。这一发现提示后期延迟是人类种植前胚胎嵌合体的主要原因。Coonen 等和Capalbo等发现后期延迟比不分离的发生率高3~5倍。
3.核内复制:核内复制是有丝分裂后,子代细胞内某一条或几条染色体再次发生复制,导致一个细胞里有三体性染色体,而另一个细胞里是二体性染色体。染色体增加有两种可能机制:一种是由于细胞周期功能障碍,一个染色体复制但是随后没有细胞质分裂,另一种是有丝分裂开始后很快结束,导致染色体复制。无论发生机制如何,结果都会导致一条染色体的增加。核内复制又称为多倍体。多倍体可以出现在血液、肠道、皮肤和大脑中。
二、嵌合体胚胎发生率
既往研究报道胚胎嵌合体发生率不一,从30%到90%不等。欧洲人类生殖与胚胎学会指南(ESHRE)给出的嵌合体发生率为40%~60%。报道的差异可能和应用荧光原位杂交技术(FISH)有关。FISH技术可以检测每个细胞的细胞遗传学信息,因此很多文献应用该技术进行检测。但是FISH技术本身存在局限性,例如需要细胞固定,该操作难以掌握,且方法多样,部分方法出错率很高,并且诊断胚胎异常的标准不一。检测的材料对结果也有影响,如果检测的是发育阻滞的胚胎,则出现嵌合体的几率比形态正常的胚胎高。实验室培养环境(温度、pH值、培养液成分等)也会影响嵌合体胚胎的诊断。无论是卵裂期胚胎或囊胚应用合适的FISH方法,嵌合体的检出率都可控制在30%左右。
单核苷酸多态性(SNP)、比较基因组杂交(aCGH)、定量PCR(qPCR)和二代测序(NGS)等分子细胞学技术比FISH更具有优势,可以同时对 24 对染色体进行检测。但是由于对每个细胞都进行检测费用昂贵,因此很少用于诊断胚胎是否为嵌合体。很多新的研究应用全面染色体筛查(CCS)技术,通过囊胚活检,一次活检约5个细胞作为一个整体进行分析。由于正常细胞和非整倍体细胞混合检测,难以准确诊断嵌合体。不同检测方法得出卵裂期胚胎活检嵌合体发生率在15%~75%。
由于卵裂期胚胎嵌合体发生率高,目前学界倾向于对第5天或第6天囊胚进行滋养外胚层活检,同时应用CCS技术,对胚胎进行更全面的评估。囊胚期活检的优点在于比起卵裂期胚胎,可以活检更多的细胞(大约5~10个),对非整倍体筛查更加全面。嵌合体囊胚的多细胞活检容易检出不同细胞系来源的细胞,单次活检即可以做出诊断。文献报道卵裂期嵌合体发生率最高,在15%~90%,囊胚活检嵌合体发生率在3%~24%之间。
和非整倍体不同,嵌合体发生率不会随着年龄增大而增加,不同年龄的女性囊胚嵌合体发生率均约为30%。但是,由于高龄女性更容易出现减数分裂错误,囊胚活检细胞全部为整倍体细胞的几率降低,文献报道35岁以下的女性整倍体细胞占48.2%,42岁以上的女性仅占10.6%。有丝分裂错误导致嵌合体的发生,减数分裂错误导致非整倍体发生,而有丝分裂错误可伴随减数分裂错误从而导致胚胎嵌合体,因此对这部分人群可进行胚胎植入前非整倍体筛查(PGS-A)。目前应用非常广泛的是NGS技术,由于测序深度和平台的不同,检测细胞的敏感性也不同,因此导致PGS-A的结果也可能出现不同。
三、如何检测出嵌合体胚胎
NGS有多个平台,检测嵌合体的敏感性也不同。国际上最广泛应用的高分辨NGS(hr-NGS)方法是Illumina公司的VeriSeq PGS。利用MiSeq台式测序仪,对短片段 DNA序列进行读取。不需要对每一个染色体片段都进行测序,为了降低检测费用,只需要同时检测部分DNA&34;,以判断被检测标本是否为嵌合体。
hr-NGS可以检测出异常细胞占20%~80%的嵌合体,由于每个囊胚平均活检5~10个细胞,hr-NGS可以检测出1/5(20%)至4/5(80%)的嵌合性。但是,也有观点质疑hr-NGS诊断嵌合体的准确性。有研究认为hr-NGS 不能区别低比例嵌合和背景噪音,还有观点认为嵌合体检测存在缺陷,如果三体和单体细胞数目相等,检测结果将会是整倍体。但是一项初步研究通过对同一胚胎进行多次活检,然后应用hr-NGS进行检测,结果发现28个胚胎中仅有两个胚胎同时有单体和三体细胞系,提示这种现象很少发生,因为当胚胎发育到囊胚期时一个异常细胞系已经替代另一异常细胞系。
四、嵌合体胚胎移植后流产率和生育健康孩子的几率
当PGS检测结果同时有整倍体和嵌合体时,应优先选择整倍体胚胎进行移植。但是如果检测结果仅有嵌合体胚胎,是否应该移植嵌合体胚胎仍然有争议。Bolton等通过构建小鼠嵌合体模型,发现非整倍体细胞的结局取决于细胞谱系。胎儿谱系的非整倍体细胞可通过凋亡清除,胎盘谱系的非整倍体细胞出现严重的生长缺陷。
Fiorentino等研究发现,移植18个嵌合体胚胎(嵌合细胞占35%~50%),其中6个最终正常活产。
文献报道约40%的嵌合体胚胎移植后可以获得妊娠,但是与滋养外胚层细胞活检正常的囊胚相比,嵌合体胚胎种植率低,流产风险高,且复杂嵌合体(约占总胚胎的4.5%)比仅有一两条染色体嵌合的胚胎明显种植率低。
PGS诊断为嵌合体的胚胎有自我纠正的机制,学说包括以下几种:整倍体细胞优势生长、异常细胞自我纠正、正常细胞向内细胞团聚集。三体细胞群可通过后期延迟或染色体不分离以丢失多余的染色体达到自我纠正,但是这种情况可能性很小,因为在囊胚检测中很少发现单亲二体。
研究发现非整倍体细胞生长慢,可在细胞凋亡过程中死亡,在胚胎发育过程中数量逐渐减少,最终健康胎儿出生。
嵌合发生的染色体号数和持续种植率无关,除了17号染色体外,几乎所有出现嵌合的染色体都有最终妊娠。染色体的大小和持续种植率也无关,但是大染色体的嵌合部分显著比小染色体多。
对于活检滋养外胚层的5~10个细胞能否准确代表整个胚胎仍不清楚,因此这就可以解释为什么异常细胞>40%的嵌合胚胎移植后也有着床的。胎儿或新生儿的嵌合型可导致先天畸形,自闭症和精神发育迟缓。每条染色体的嵌合型都可能导致异常表型。异常表型可能胎儿发育正常,也可能受到严重影响,基因型与表型的关系很难判断。因此,理论上所有移植嵌合体胚胎的妊娠和活产都应该检查胎儿染色体核型,并且对孩子的发育进行长期随访。
PGDIS指南建议,对于移植嵌合胚胎妊娠的女性需做羊水穿刺进行产前诊断。仅进行无创产前检查和绒毛活检是不够的,因为它们只检查滋养外胚层(形成胎盘),并不能检测内细胞团(形成胎儿)。
五、如何处置嵌合体胚胎
是否移植嵌合体胚胎需要考虑多方面因素,例如PGD的检测方法、嵌合程度、嵌合发生在哪条染色体、患者的要求等。一些实验室用截点值来区分嵌合型胚胎是正常或异常,通常把异常细胞的截点值定为40%或50%,但是这样容易出现假阳性(浪费正常胚胎)和假阴性(导致误诊和可能的并发症)。嵌合体是除了整倍体和非整倍体以外的第三种胚胎类型,在移植级别中次优于整倍体胚胎。
如果没有整倍体胚胎,根据患者的需求,进行遗传咨询,在充分了解风险和知情同意的情况下,可以考虑移植嵌合体胚胎。对于移植嵌合体胚胎妊娠的患者,建议行产前诊断。