国外有哪些CAR-T疗法?
血液肿瘤治疗界的“抗癌利器”——CAR-T疗法
随着2021年阿基仑赛注射液、瑞基奥仑赛注射液先后在中国获批上市,2022年西达基奥仑赛获美国FDA批准上市,CAR-T疗法已然进入井喷期。
作为一种“活的”药物,CAR-T疗法与传统药物有着很大的区别。它是一种治疗肿瘤的新型精准靶向疗法。通过基因工程技术将T细胞激活,并装上定位导航装置CAR(肿瘤嵌合抗原受体),将T细胞这个普通“战士”改造成“超级战士”,即CAR-T细胞,专门识别体内肿瘤细胞,并高效杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。与传统的化疗和造血干细胞移植相比,它对肿瘤细胞的杀伤更为精准,在提高疗效的同时大幅减轻了毒副作用。
目前,CAR-T在急性粒细胞性白血病、慢性粒细胞性白血病、非霍奇金淋巴瘤、多发性骨髓瘤中取得了显著的疗效。
非霍奇金淋巴瘤
2022年8月31日,国际顶级期刊《Nature》发表了一项来自我国团队的重磅科研成果,该研究首次报道了全新一代非病毒定点整合CAR-T技术的开发及其治疗复发/难治性B细胞非霍奇金淋巴瘤的临床试验效果。

研究者们纳入8例此前未经CAR-T治疗的复发/难治性B细胞非霍奇金淋巴瘤作为研究对象。患者首先经环磷酰胺和氟达拉滨联合化疗,然后输注一次PD1-19bbz CAR-T,剂量为0.56×106-2.35×106个细胞/kg。部分患者中观察到轻度细胞因子释放综合征(CRS),没有观察到免疫效应细胞相关神经毒性综合征(ICANS)。
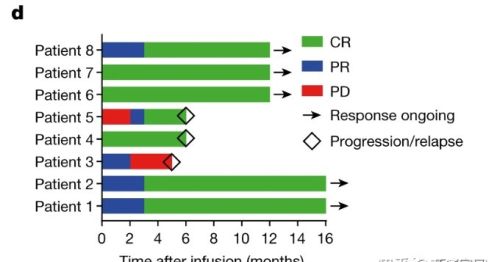
患者输注后的治疗反应和反应持续时间
在12个月的中位观察期内,8名患者有7名(87.5%)实现了完全缓解(CR),1例为部分缓解,最后一次随访时有5例患者仍有持久的反应,生存期已超1年。首位患者无癌生存已超2年,目前仍处于疾病完全缓解的状态。
在最近的一次随访中,孙先生的所有检查项目均达标,体重也比患病前增加了不少,脸色看起来也更红润了。他不禁感叹:“经过细胞治疗后身体感觉一下子就恢复正常了,亲朋好友也都说我是奇迹般地康复了,现在闲暇时还会去打打羽毛球,完全恢复了患病前的生活状态。感谢新型CAR-T细胞疗法,让我还能看到儿子上大学。感谢医院的精心治疗,帮助我战胜病魔,获得重生。”
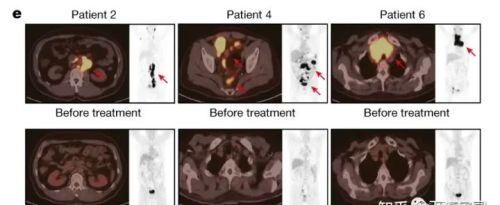
三位代表性患者治疗前后的PET-CT扫描(红色箭头表示肿瘤病变)
目前,无癌家园有一款靶向CD19或CD20复发难治侵袭性非霍奇金淋巴瘤的CAR-T疗法正在临床研究中。
目前急招B细胞淋巴瘤、T细胞淋巴瘤、T细胞白血病(T-ALL)、急性淋巴细胞白血病、非霍奇金淋巴瘤、肝癌、胰腺癌、结直肠癌、间皮瘤、卵巢癌等癌种!
想要评估病情是否能够接受CAR-T疗法可将病理报告、治疗经历及出院小结等提交至无癌家园医学部(四零零六二六九九一六)进行初步评估!
逐步突破CAR-T治疗实体瘤瓶颈,经改造抗癌效果突飞猛进!
CAR-T疗法用于实体瘤的关键点就是实体瘤靶点的选择,目前目前临床在研的CAR-T项目涉及的靶点分布情况,以2022年最新的全球癌症数据为例,主要集中在GPC3、Claudin18.2、MSLN等热门靶点上。
胃癌、胰腺癌:靶点Claudin18.2
作为国际上首个针对Claudin18.2的CAR-T细胞,CT041从2019年首次亮相就惊艳世界,其显著的疗效展现出对消化系统肿瘤的良好治疗前景。
2022年5月9日,科济药业CAR-T细胞产品CT041治疗消化系统肿瘤的研究结果发表在国际顶级期刊《Nature Medicine》杂志上,这也算是首个发表于顶级学术期刊的迄今为止最大样本量的CAR-T细胞治疗实体瘤的临床研究!
研究数据显示
1. 所有患者的客观缓解率达48.6%,疾病控制率达73%;所有胃癌患者总客观缓解率为57.1%,疾病控制率达75.0%。
2. 既往接受至少2线治疗失败的胃癌患者:客观缓解率为61.1%,疾病控制率为83.3%。
除此之外,还有多款靶向CLDN18.2的CAR-T细胞疗法。例如,由传奇生物研发的LB-1904,用于治疗胃癌或者胰腺癌,目前已经进入临床I期试验。此外,我国还有多款针对Claudin18.2的临床试验正在进行临床试验招募中。
肝癌:靶点GPC3(磷脂酰肌醇蛋白多糖3)
2022年8月18日,科济药业宣布,《Frontiers in Immunology》杂志上发表了关于其自主研发的靶向GPC3的CAR-T细胞候选产品CT011治疗晚期肝细胞癌的长期生存案例报告。
此项研究报道了1名晚期肝细胞癌患者在接受GPC3 CAR-T细胞与索拉非尼联合治疗后获得了完全缓解(CR)和长期生存。
这是一名患有乙型肝炎病毒(HBV)相关肝细胞癌的60岁男性,CT011联合索拉非尼治疗耐受性良好。患者从第3个月开始达到部分缓解(PR),并在第一个 CT011 输注周期后的第12个月达到完全缓解。肿瘤超过36个月(超3年)没有进展,在第一次输注后保持完全缓解状态超过24个月。
结直肠癌:靶点GCC/GUCY2C
2022年4月19日,上海斯丹赛生物宣布,其开发的实体瘤CAR-T产品GCC19CART被美国食品和药物管理局(FDA)授予快速通道资格。
在ASGCT会议上,斯丹赛介绍了关于21例患者的最新临床数据,其中13患者以1级剂量(1x106 cells/kg)入组,8名患者以2级剂量(2x106cells/kg)入组。根据实体肿瘤疗效评价标准(RECIST1.1),1级剂量组客观缓解率(ORR)为15.4%(2/13),2级剂量组客观缓解率为50%(4/8)。
除了靶点GCC外,结直肠癌另外一个有效靶点GUCY2C也是近期研究热门,中国有一项针对7名患者的小型 CAR-T 研究,以结肠癌标志物GUCY2C为靶点。该研究发现,2~3 例患者出现部分缓解和疾病稳定。
间皮瘤、卵巢癌:靶点MSLN
间皮瘤
2021年11月,来自美国的医学研究者们发布了一项CAR-T联合PD-1抑制剂的临床试验的I期结果在知名《Cancer Discovery》杂志上,主要阐述了以间皮素为靶点的自体CAR-T细胞与帕博利珠单抗(pembrolizumab,商品名Keytruda)联用治疗恶性胸膜间皮瘤(MPM)的临床疗效。
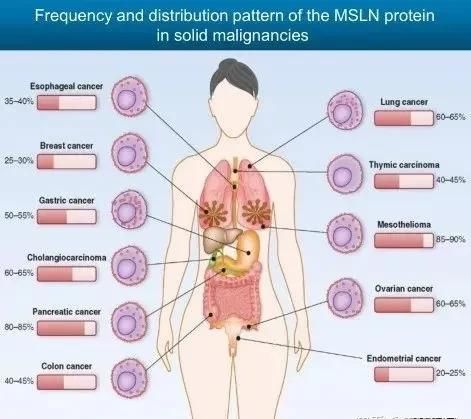
间皮素高表达于多种肿瘤组织,比如胰腺癌、卵巢癌、乳腺癌、子宫内膜癌、前列腺癌以及胆管癌等(图片来源 PNAS)
在此项临试验中,共纳入27例患有胸腔肿瘤的患者接受治疗,其中转移性肺腺癌1例,转移性乳腺癌1例,其余均为恶性胸膜间皮瘤患者。
27例患者中,有23例恶性胸膜间皮瘤患者在CAR-T治疗前进行环磷酰胺预处理,其中有18例患者接受CAR-T联合pembrolizumab治疗,5例仅接受CAR-T治疗。值得一提的是,所有患者均接受过一轮既往治疗,33%的患者接受过≥3轮的既往治疗。
需要指出的是,恶性胸膜间皮瘤是一种PD-L1表达及肿瘤突变负荷均较低的恶性肿瘤,前期的临床试验也证明患者不能受益于PD-1/PD-L1免疫抑制剂的单药治疗。
入组的患者从确诊到接受CAR-T治疗平均间隔6.1个月,从CAR-T治疗到开始帕博利珠单抗治疗平均间隔6周。令人惊喜的是,在3×105~6×107/kg的CAR-T剂量范围内,研究人员并没有发现剂量限制性毒性。没有患者出现二级以上细胞因子风暴、神经系统毒性、及脱靶导致的副作用。
在确保安全性和持续性良好的细胞制品的前提下,临床效果也让人格外惊艳!
23例接受治疗的恶性胸膜间皮瘤患者中,CAR-T治疗后的中位生存期为17.7个月,一年存活率为74%。而在18名接受了CAR-T+帕博利珠单抗联合治疗的患者中,中位生存期达到了23.9个月,一年存活率为83%。
更惊人的发现是,靶向间皮素的CAR-T疗法有望在恶性胸膜间皮瘤患者中实现长期的疾病缓解。在治疗后第4~6周的影像检查中(n=16),有12.5%的患者的疗效达到了部分缓解,56.3%的患者为疾病稳定。在疾病稳定或部分缓解的患者中,有8名患者能够维持疾病状态超过6个月。
卵巢癌
2018年7月,MaxCyte宣布,公司基于mRNA非病毒技术开发的治疗实体瘤的CAR细胞疗法已被FDA批准开始临床试验,同时,这也是MaxCyte全资拥有的第一个CAR项目MCY-M11,靶点正是间皮素(MSLN),通过腹腔内注射治疗复发/难治性卵巢癌和腹膜间皮瘤患者。
优秀作者:无癌家园i