小儿晚上发烧咳嗽怎么办(幼儿舞蹈蛙趣)
推出物质性质的方法:1.由物质结构推出其物理性质的方法
四、学习物质的初级思维方式和发展到高级思维方式
(二)学习物质的初级思维方式时形成的化学理论或获得的方法
VII、运用元素周期表及其补充:共价键的键能、电离常数;原子、分子、晶体结构推出物质性质的方法
即图2(化学的高级基本思维方式)中的红色部分:
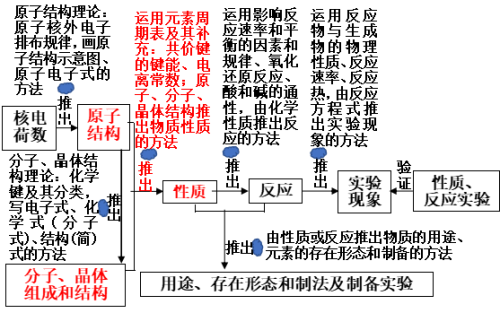
三、推出物质性质的方法
(一)由物质结构、元素周期表推出物质的物理性质的方法:
物理性质:不需要通过化学变化体现的性质。包括:物质本身固有的性质:某条件下,物质的颜色、光泽、状态、气味(生物作用)、密度;通过物理变化体现的性质:溶解性或溶解度、熔点、沸点、挥发性、硬度、导电性、传热性、延展性。
1.由物质结构推出其物理性质的方法:
(1)运用相似相溶原理,根据分子的极性推出物质的溶解性的方法:
水分子是极性分子,由非极性分子组成的物质难溶于水,如氢气、氮气、氧气、甲烷、四氯化碳等;氯气、溴单质、碘单质、二氧化碳等在水中溶解度不大。极性越接近水分子的极性的分子越易溶于水,如氨气、氟化氢(氨气、氟化氢分子与水分子之间还存在氢键)、氯化氢、溴化氢、碘化氢等。
有机溶剂的分子或极性较小,如乙醇、氯仿即三氯甲烷等,或属于非极性分子,如苯、四氯化碳等,由非极性分子组成的物质易溶于有机溶剂,如氢气、氮气、氧气、甲烷、四氯化碳、氯气、溴单质、碘单质、二氧化碳等。由极性越强的分子组成的物质越难溶于有机溶剂,如氨气、氟化氢(氨气、氟化氢分子与水分子之间还存在氢键)、氯化氢、溴化氢、碘化氢等。
总之,溶剂粒子与溶质粒子之间的作用力比溶质与溶质、溶剂与溶剂之间的作用力大越多,溶质就越易溶于溶剂中。
(2)运用每类晶体的共同物理性质,推出所学晶体的水溶性和熔沸点、导电性、传热性、延展性、金属光泽、硬度的方法:
原子晶体的熔沸点高,硬而脆,难溶于水等一般溶剂。
离子晶体的熔沸点较高,硬而脆,多数能溶于水,其水溶液和熔融状态能导电。
分子晶体的熔沸点低,多数硬度小且脆。
金属晶体熔沸点差异大,能导电、能传热、有延展性和金属光泽,除活泼金属跟水反应而溶于水外,其它金属难溶于水。
可由物质的熔沸点判断该物质在某温度和某压强下的状态。
(3)根据物质的结构比较物质的熔沸点、硬度和挥发性的方法:
首先要认识,熔化沸腾时,离子晶体破坏的是离子键;金属晶体破坏的是金属键;原子晶体破坏的是共价键;分子晶体破坏的是分子间作用力。所要破坏的相互作用越强,晶体的熔沸点越高。
A、根据不同类型典型晶体中相互作用的相对强弱比较不同晶体的熔沸点、硬度等:
原子晶体、离子晶体(或金属晶体)、分子晶体的熔沸点一般依次降低,硬度一般依次减小,挥发性一般依次增强。如典型的原子晶体金刚石、典型的离子晶体氯化钠、相对分子质量不是很大的分子晶体二氧化碳晶体等,它们的熔沸点依次降低,硬度依次减小,挥发性依次增强。但要注意,由于每类相互作用都受到许多因素影响,所以其强弱也相差甚远,因此以上规律并非绝对,只对典型的晶体才适用。如,离子晶体MgO的熔沸点比原子晶体的SiO2的高;金属晶体钠、钾、汞等的熔点比分子晶体硫的低。
B、根据影响每类相互作用强弱的因素与规律比较同类晶体中不同物质的熔沸点、硬度和挥发性:
①离子晶体:阴阳离子带的电荷数越多,阴阳离子半径越小,离子键越强,一般,熔沸点越高,硬度越大。由此可推出都属离子晶体的氯化钠的熔点比氯化钾的高,硬度比氯化钾的大。
②金属晶体:金属原子的价电子数越多,金属阳离子半径越小,金属键越强,熔沸点越高,硬度越大,越难挥发。由此可推出都属金属晶体的锂、钠、钾、铷、铯的熔沸点依次降低,硬度依次减小,挥发性依次增强;钠、镁、铝或钾、钙、铁的熔沸点依次升高,硬度依次增大,挥发性依次减弱。
③原子晶体:共价键越短,共价键越强,熔沸点越高,硬度越大,越难挥发。由此可推出都属原子晶体的金刚石、碳化硅、硅晶体的熔沸点依次降低,硬度依次减小,挥发性依次增强。
④分子晶体:
a、分子的组成:氮、氧、氟的氢化物在液态和固态时分子之间存在比较强的氢键,熔沸点比较高,液体比较难挥发。如,熔沸点:NH3>PH3;H2O>H2S;HF>HCl。
b、分子的极性:其他因素相同时,分子的极性越强,分子间作用力越大,熔沸点比较高,液体比较难挥发。如,熔沸点:NH3>CH4;CO>N2。
c、分子的形状:其他因素相同时,分子的链越直,分子间的距离越小,分子间作用力越大,熔沸点比较高,液体比较难挥发。如,熔沸点:正丁烷>异丁烷。
d、相对分子质量:其他因素相同时,相对分子质量越大,分子间作用力越大,熔沸点比较高,液体比较难挥发。如,熔沸点:硒化氢>硫化氢;一般,同系物随着碳原子数增加熔沸点升高。
e、熔点不但受融化时破坏的相互作用的强弱影响,而且受结构单元的对程度影响。其相互作用力相同时,结构单元的对程度越高,晶体的熔点越高。如,熔点:新戊烷>正戊烷>异戊烷;甲烷>乙烷>丙烷等。
另外,金属晶体具有的共性是:能导电、传热、有延展性、有金属光泽。离子晶体在熔融时能导电、传热。
温馨提示:通过以上关于推出物质性质的方法:1.由物质结构推出其物理性质的方法内容介绍后,相信大家有新的了解,更希望可以对你有所帮助。