化学二氧化硅的用途(二氧化硅的化学)
化学学习——二氧化硅
1,存在
(1)分布广:地壳上的岩石、土壤和沙子的主要成分都是硅的氧化物和硅酸盐。约占地壳质量的90%以上。
(2)含量多:含26.3%,居第二位。 (3)化合态:自然界中硅全部都存在于化合物中,无游离态(亲氧性较碳强)。 水晶,玛瑙,沙石等物质的主要成分为二氧化硅。

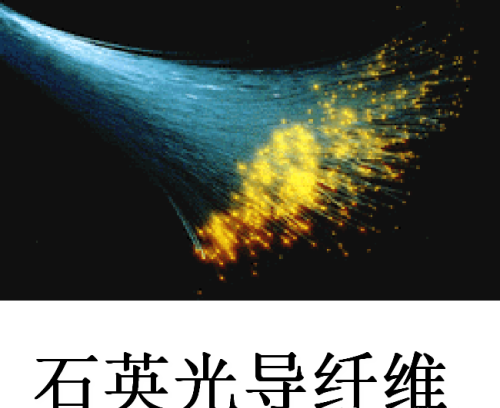

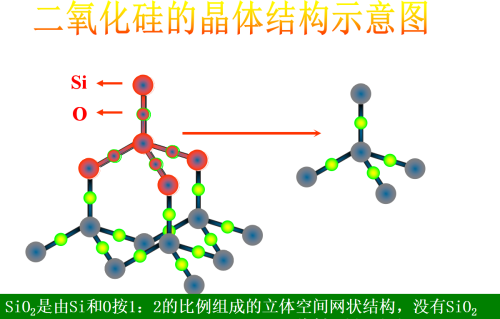
2,结构
二氧化硅晶体是一种空间网状结构 二氧化硅晶体中没有SiO2分子,“SiO2”是二氧化硅的化学式,不是其分子式。
3,物理性质
砂石硬度大熔点高、石英可做坩埚——SiO2的硬度大熔点高。
石英和光导纤维是无色透明的— 纯净的SiO2是无色的。
砂石的化学性质稳定—SiO2的化学性质稳定。
SiO2的这些性质都是由其空间网状结构决定的。
所以性质决定用途,用途反映性质。
4,化学性质
(1)SiO2的化学性质很不活泼,酸中只有氢氟酸(HF)能与之反应。
SiO2+4HF=SiF4↑+2H2O
玻璃中含有SiO2 ,可以用HF刻蚀玻璃。
(2)SiO2 是酸性氧化物,可与碱性氧化物和碱反应。
SiO2+2NaOH=Na2SiO3+H2O
实验室中装盛NaOH 的试剂瓶用橡皮塞或软木塞而不用玻璃塞(玻璃中含有SiO2,其与NaOH反应生成的Na2SiO3会把玻璃塞和瓶粘在一起。时间长了,瓶塞就打不开)
所以二氧化硅是酸性氧化物,不是碱性氧化物。
5,二氧化硅的特性
(1)酸性氧化物一般能与水反应生成对应的酸,但SiO2不溶于H2O,不能直接与H2O反应生成H2SiO3。
(2)非金属氧化物的熔点一般较低,但二氧化硅的熔点很高。
(3)酸性氧化物一般不与酸反应,但SiO2可以与氢氟酸反应:SiO2+4HF===SiF4↑+2H2O。

温馨提示:通过以上关于化学学习——二氧化硅内容介绍后,相信大家有新的了解,更希望可以对你有所帮助。