高中化学实验知识点总结大全(高中化学常考的29个实验总结)
高中化学丨必背18个实验知识点

01
配制一定物质的量浓度的溶液
必会知识1:容量瓶使用的四个“不能”
(1)不能将固体或浓溶液直接在容量瓶中溶解或稀释;
(2)不能作为反应容器或用来长期贮存溶液;
(3)不能将过冷或过热的溶液转移到容量瓶中,(因为容量瓶的容积是在瓶身所标温度下确定的);
(4)不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液。
必会知识2:配制一定物质的量浓度溶液的操作步骤
(1)计算溶质的质量;
(2)称量;
(3)配制溶液(溶解、移液、洗涤、定容、摇匀);
(4)将配制好的溶液倒入试剂瓶,贴好标签。
必会知识3:配制一定物质的量浓度溶液的误差分析
原理依据:
若m偏大或V偏小,则c偏高;若m偏小或V偏大,则c偏低。
02
铁及其化合物的性质
必会知识1:铁及其化合物的性质
(1)铁单质的还原性:Cu2++Fe===Fe2++Cu;
(2)铁盐的氧化性:2Fe3++2I-===2Fe2++I2;
(3)亚铁盐的氧化性和还原性:Fe2++Zn===Zn2++Fe,10Fe2++2MnO4-+16H+===10Fe3++2Mn2++8H2O。
必会知识2:铁离子的检验
(1)向含Fe3+的溶液中滴加几滴KSCN溶液,溶液变红色;
(2)向含Fe3+的溶液中加入适量铁粉,轻轻振荡片刻,溶液变绿色,再滴加几滴KSCN溶液,溶液无明显变化,2FeCl3+Fe===3FeCl2。
03
用化学沉淀法去除粗盐中的离子
必会知识1:粗盐提纯时试剂的加入顺序
可以为BaCl2—NaOH—Na2CO3—HCl
排序关键:Na2CO3溶液在BaCl2溶液之后加,最后加稀盐酸
必会知识2:除杂实验方案设计的原则
(1)不增(不引入新的杂质)
(2)不减(一般不减少被提纯的物质)
(3)易分离(被提纯的物质与杂质易分离)
(4)易复原(被提纯的物质易复原)
04
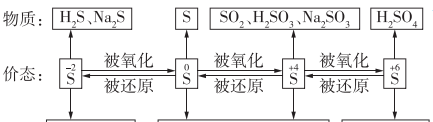
不同价态含硫物质的转化
必会知识:
应用氧化还原反应原理实现不同价态含硫物质间的转化
05
同周期、同主族元素性质的递变
必会知识:
(1)同主族元素性质的递变
由化学方程式:2NaBr+Cl2===2NaC1+ Br2,2NaI+ Br2===2NaBr+I2,可知卤素单质的氧化性:Cl2>Br2>I2,卤族元素的非金属性:Cl>Br>I。
结论:同主族元素,从上到下,非金属性逐渐减弱,金属性逐渐增强。
(2)同周期元素性质的递变
①与水反应的剧烈程度:Na>Mg,金属性:Na>Mg。
②Mg(OH)2、Al(OH)3的碱性强弱比较:Mg(OH)2不溶于NaOH溶液,Al(OH)3溶于NaOH溶液,显两性,碱性:Mg(OH)2>Al(OH)3,金属性:Mg>Al。
结论:同一周期元素,从左至右,金属性逐渐减弱,非金属性逐渐增强。
06
简单配合物的形成
必会知识:
(1)配合物的组成特点
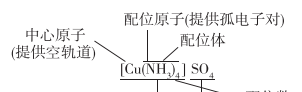
(2)简单离子与配离子的区别
中心离子形成配合物后性质不同于原来的金属离子,具有新的化学特性,K3[Fe(CN)6]中,Fe3+与CN-形成了稳定的配离子,[Fe(CN)]3-的氧化性弱于Fe3+,[Fe(CN)6]3-遇亚铁盐生成深蓝色沉淀,化学上常用于Fe2+的检验。
07
化学反应速率的影响因素
必会知识:化学反应速率的影响因素
(1)温度:升高温度,反应速率加快;
(2)浓度:增加浓度,反应速率加快;
(3)催化剂:使用催化剂,反应速率加快;
(4)压强:增加气体反应物的压强,反应速率加快;
(5)反应物接触面积:增大反应物接触面积,反应速率加快。
08
探究影响化学平衡移动的因素
必会知识:
(1)浓度对化学平衡的影响
在其他条件不变时,增大反应物浓度,平衡正向移动;减小反应物浓度,平衡逆向移动。
(2)温度对化学平衡的影响
对于放热反应,在其他条件不变时,升高温度,平衡逆向移动,降低温度,平衡正向移动。
对于吸热反应,在其他条件不变时,升高温度,平衡正向移动,降低温度,平衡逆向移动。
09
强酸与强碱的中和滴定
必会知识:
(1)中和滴定的原理
利用酸碱中和反应H++OH-===H2O和酸碱指示剂的颜色改变判定终点。
(2)滴定管
酸式滴定管可用于盛酸性、中性、氧化性溶液;碱式滴定管可用于盛碱性、中性溶液。
使用方法:检漏、润洗、加入反应液、调节起始读数、放出反应液。
(3)滴定操作
(用已知浓度的强酸滴定未知浓度的强碱,酚酞为指示剂)
①锥形瓶放在酸式滴定管的下方→垫一张白纸→滴加标准盐酸→边滴边摇动锥形瓶-→接近终点,改为滴加半滴酸。
②溶液由粉红色变为无色, 且半分钟内不恢复原色一达到滴定终点→记录滴定管液面的读数。
③取三次测定实验消耗标准盐酸体积的平均值,计算待测NaOH溶液中c(NaOH)。
10
盐类水解的应用
必会知识:盐类水解的应用
(1)氯化铁溶液配制:配制FeCl3溶液时需要加入HCl溶液抑制铁离子水解
(2)饱和氯化铁溶液和硫酸铝进行水的净化:Al3++3H2O ⇌Al(OH)3(胶体)+3H+
(3)氢氧化铁胶体制备:Fe3++3H2O ⇌Fe(OH)3(胶体)+3H+
(4)饱和碳酸钠溶液去油污:CO32-+H2O⇌HCO3-+OH-
11
化学能转化成电能
必会知识:
(1)原电池的工作原理
负极失去电子发生氧化反应,电子通过导线流入正极,溶液中的离子在正极上得到电子发生还原反应。
(2)原电池的构成要素
①自发进行的氧化还原反应;
②活动性不同的电极材料(金属、石墨棒);
③形成闭合回路(导线、电解质溶液等)
12
简单的电镀实验
必会知识:
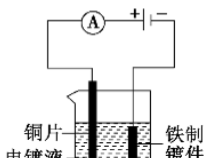
(1)电镀原理
把铁制镀件与直流电源的负极相连(作阴极:Cu2++2e-===Cu),铜片与直流电源的正极相连(作阳极:Cu-2e-===Cu2+)如图所示,将两极平行浸入电镀液(CuSO4溶液)中,两极间距约5 cm, 5~10 min后取出,观察到铁制镀件表面附着铜,电镀液颜色不变。
(2)工业生产中提高电镀质量的方法
①镀前对镀件进行处理,一般包括机械加工、酸洗、除油等。②电镀时需要注意电镀液的配方、电流的选择以及温度等的调节。③电镀后对镀件进行处理,如防变色处理等。
13
制作简单的燃料电池
必会知识:
氢氧燃料电池的工作原理和电解水的原理比较
电极
电极反应
电解水
阳极
2H2O-4e-===4H++O2↑
阴极
2H++2e-===H2↑
氢氧燃料电池
(碱性电解质)
负极
H2-2e-+2OH-===2H2O
正极
O2+4e-+2H2O===4OH-
14
搭建球棍模型—
认识有机化合物分子结构的特点
必会知识:
(1)甲烷、乙烯、乙炔的结构特点
球棍模型
结构特点
甲烷
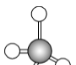
甲烷分子中的5个原子形成正四面体结构,碳原子位于正四面体的中心,4个氢原子分别位于4个顶点,分子中的4个C—H键长度相同,相互之间的夹角相等
乙烯

碳碳之间形成双键,2个碳原子和4个氢原子在同一平面内,C-H和C==C之间的夹角为120°
乙炔

碳碳之间形成三键,2个氢原子和2个碳原子在同一直线上,分子中C-H和C≡C之间的夹角为180°
(2)碳原子的成键特征
①碳原子与周围的原子形成4个共价键,可以是链状,也可以形成环状,可以形成C—C、C==C或C≡C;
②C==C中的碳原子及两端碳原子所连原子共平面,C≡C中的碳原子及两端碳原子所连原子共直线。
15
乙醇、乙酸的主要性质
必会知识1:乙醇的主要性质
(1)乙醇与钠反应生成氢气:2Na+2CH3CH2OH2CH3CH2ONa+H2↑。
(2)乙醇的氧化反应:
①乙醇的燃烧:CH3CH2OH+3O22CO2+3H2O
②乙醇的催化氧化反应:2CH3CH2OH+O22CH3CHO+2H2O
③乙醇可被酸性高锰酸钾溶液或酸性重铬酸钾溶液氧化,生成乙酸
必会知识2:乙酸的主要性质
(1)乙酸的酸性强于碳酸;
(2)乙酸与乙醇的酯化反应,酯化反应的实质是酸脱羟基、醇脱氢(羟基上的):
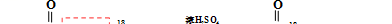
16
乙酸乙酯的制备与性质
必会知识:
(1)制备原理
在浓硫酸催化下,乙酸和乙醇发生酯化反应,生成乙酸乙酯:

(2)试剂加入顺序:乙醇→浓硫酸→乙酸
浓硫酸稀释时会放出大量热,因此需将浓硫酸慢慢注入乙醇中,最后加乙酸是为了防止乙酸受热蒸发而损失。
(3)酯化反应为可逆反应,制备过程中应使平衡正向移动,以提高产率。
17
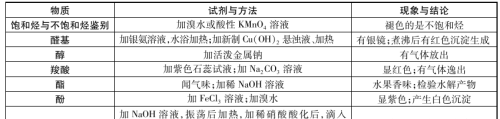
有机化合物中常见官能团的检验
必会知识:常见官能团的检验方法
18
糖类的性质
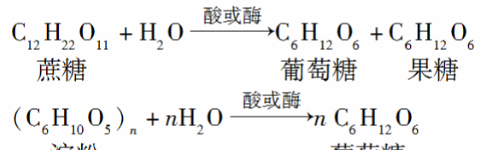
必会知识:
(1)蔗糖和淀粉的水解
(2)葡萄糖还原性的检验
银镜反应:
CH2OH(CHOH)4CHO+2Ag(NH3)2OH CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O
CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O
与新制氢氧化铜反应:
CH2OH(CHOH)4CHO+2Cu(OH)2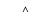 CH2OH(CHOH)4COOH+Cu2O↓+2H2O
CH2OH(CHOH)4COOH+Cu2O↓+2H2O
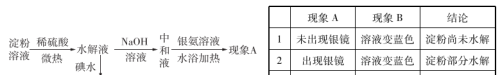
(3)淀粉水解程度的检验
来源:本文来源网络,版权归相关权利人所有,如侵权,请联系删除。
温馨提示:通过以上关于高中化学丨必背18个实验知识点内容介绍后,相信大家有新的了解,更希望可以对你有所帮助。