光气中毒原理(光气中毒事件)
高中化学周边——光气简介;光气中毒怎么办?
光气介绍
化学式:COCl2,碳酰氯的俗名。又名“光成气”的简称,译自希腊文phos(光)+gene(产生)。光气最初是由氯仿受光照分解产生,故有此名。光气从化学结构上看是碳酸的二酰氯衍生物,是非常活泼的亲电试剂。 光气通常用于有机合成、制造染料、塑料和其他中间体(如异氰酸酯),制造农药和制药等行业,也曾用作军用毒剂。比空气重3倍以上。对黏膜无刺激性,使吸入高浓度光气的人体无感觉。光气主要工业用途是生产苯胺染料。
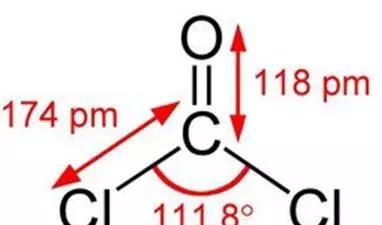
光气常温下为无色气体,有腐草味,用作有机合成、农药、药物、染料及其他化工制品的中间体。脂肪族氯烃类(如四氯化碳、氯仿、三氯乙烯等)燃烧时可产生光气。化学性质不稳定,遇水迅速水解,生成氯化氢。反应方程式:COCl2+H2O=2HCl+CO2
1、实验室制取时,可用四氯化碳与发烟硫酸反应。将四氯化碳加热至55-60℃,滴加入发烟硫酸,即发生逸出光气,如需使用液态光气,则将发生的光气加以冷凝。
反应方程式:SO3+CCl4=SO2Cl2+COCl2
2、工业上通常采用一氧化碳与氯气的反应得到光气。这是一个强烈放热的反应, 反应方程式:Cl2+CO=COCl2
3、氯仿与双氧水直接反应:
反应方程式:CHCl3+H2O2=HCl+H2O+COCl2——氯仿保管不当易被氧化产生光气。 本文来自化学自习室!
也可用双氧水制出氧气后与氯仿反应:2CHCl3+O2=2HCl+2COCl2
万一有光气漏逸, 微量时可用水蒸汽冲散;较大量时, 可用液氨喷雾解毒,也可被苛性钠溶液吸收。
COCl2+4NH3=CO(NH2)2+2NH4Cl
高考试题
例1、光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为___________;
【答案】CHCl3+H2O2=HCl+H2O+COCl2
例2、图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。
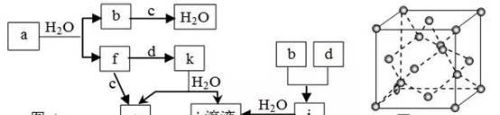
回答下列问题:
(1)图B对应的物质名称是____,其晶胞中的原子数为____,晶体类型为_____。
(2)d中元素的原子核外电子排布式为_____。 本文来自化学自习室!
(3)图A中由二种元素组成的物质中,沸点最高的是______,原因是_____,该物质的分子构型为_____,中心原子的杂化轨道类型为_____。
(4)图A中的双原子分子中,极性最大的分子是____。
(5)k的分子式为____,中心原子的杂化轨道类型为____,属于____分子(填“极性”或“非极性”)。
【答案】
(1)金刚石;8;原子晶体
(2)1s22s22p63s25
(3)H2O分子间形成氢键;V形(或角形);sp3
(4)HCl
(5)COCl2;sp2;极性
【解析】(1)每个原子周围有4个键,判断为金刚石。(2)a为C,则b为H2、c为O2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2。(3)除a、b、c、d外,f为CO,g为CO2,i为HCl,而k与水反应生成CO2与盐酸,该反应没在教材中出现过,且由f、d反应得到,应含C、O、Cl三种元素,只能判断为COCl2(光气)。所有两元素形成的物质中,只有水是液态,其它都是气体。(4)所有双原子分子中,只有H、Cl电负性差值最大,因而极性最大。(5)COCl2中羰基的平面结构显示其为sp2杂化。
光气中毒光气的毒理作用与氯气相似,但比氯气强15.5倍,具有强烈的刺激及腐蚀性,它对细小支气管,尤其是肺泡的毒性极强,造成肺毛细血管内皮损伤,渗透性增高,病人多发生肺水肿。这样,可导致病人缺乏氧气逐渐窒息。再则,血液因其血浆总量之1/3~1/2渗入肺泡,血液高度浓缩粘稠,血色素常超过140%,致使心脏因血液过于粘稠而使循环发生困难,也加重了缺氧。
凡吸入光气者应迅速脱离现场到空气新鲜处,立即脱去污染的衣物,体表沾有液态光气的部位用水彻底冲洗净。保持安静,绝对卧床休息,注意保暖。早期给氧,给予药物雾化吸入,用支气管解痉剂、镇咳、镇静等对症处理。至少要密切观察48h,注意病情变化。
个人防护措施:
1.皮肤防护使用保温手套与防护服。
2.眼睛防护使用面罩和眼睛防护结合呼吸防护用具。
3.吸入防护应用密闭系统和通风,局部排气或呼吸防护用品。
温馨提示:通过以上关于高中化学周边——光气简介;光气中毒怎么办?内容介绍后,相信大家有新的了解,更希望可以对你有所帮助。