共价键 共价晶体教案(共价键共价晶体课件)
共价键 共价晶体
在人类所利用的物质中,无论是自然界存在的,还是人工合成的,大多数是含有共价键(covalent bond)的物质。生命活动不可缺少的物质(如氧气、水、糖类、蛋白质、维生素等),各种性能优异的有机高分子材料以及治疗疾病的药物中,一般都含有共价键。
共价键的形成
通常情况下,吸引电子能力相近的原子之间通过共用电子对形成共价键。以氢分子的形成为例,当两个氢原子相互接近时,若两个氢原子核外电子的自旋方向相反,它们接近到一定距离时,两个1s轨道发生重叠,电子在两原子核间出现的机会较大。随着核间距的减小,核间电子出现的机会增大,体系的能量逐渐下降,达到能量最低状态。核间距进一步减小时,两原子间的斥力使体系的能量迅速上升,这种排斥作用又将氢离子推回到平衡位置。氢分子的形成过程中能量(主要指势能)随核间距的变化如图中曲线a所示。
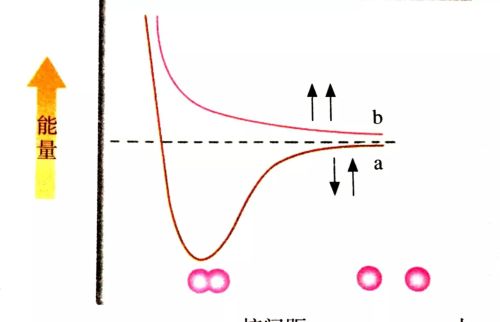
氢分子的能量与核间距的关系(a:自旋方向相反的电子 b:自旋方向相同的电子)
若两个氢分子核外电子的自旋方向相同,当它们相互接近时,原子间总是排斥作用占主导地位(如图中曲线b所示)。所以两个带有自旋方向相同的电子的氢原子不可能形成氢分子。
因此,共价键形成的本质是:当成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间的电子云密度增加,体系的能量降低。


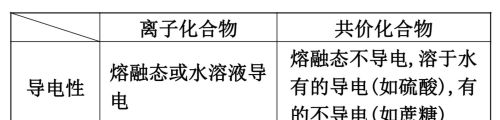

氟气分子的形成过程(轨道表示式表示)
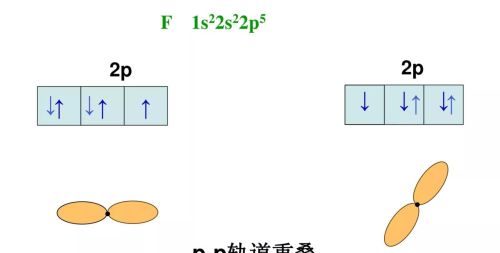
HCl的形成过程(电子式表示)
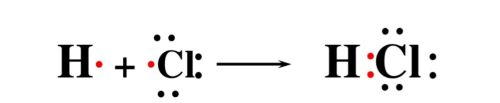
HCl的形成过程(轨道表示式表示)
【共价键的特性】
共价键具有饱和性。这是因为形成共价键时,只有成键原子中自旋方向相反的未成键电子才能形成共用电子对。成键过程中,每种元素的原子有几个未成对电子,通常只能和几个自旋方向相反的电子形成共价键。所以在共价键分子中,每个原子形成共价键的数目是一定的,这就是共价键的饱和性。
共价键具有方向性。这是因为形成共价键时,两个参与成键的原子轨道总是尽可能地沿着电子出现机会最大的发现重叠成键,而且原子轨道重叠越多,电子在两核间出现的机会越多,体系的能量下降也就越多,形成的共价键越牢固。因此,一个原子与周围原子形成的共价键就表现出方向性(s轨道与s轨道重叠形成的共价键无方向性)。s轨道与p轨道形成稳定共价键的几种重叠方式如图所示。
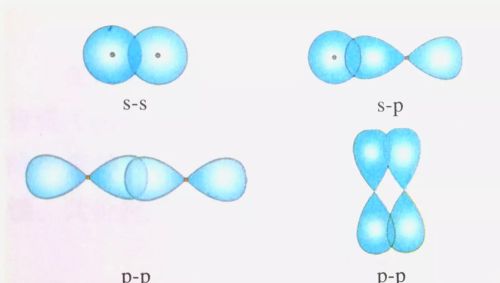
s轨道和p轨道形成稳定共价键的几种重叠方式
共价键理论的发展
为了解释共价分子的结构,美国化学家路易斯(G. N. Lewis)于1916年提出了共价键的概念,认为分子中原子间通过共用电子对使每个原子都达到稀有气体的稳定结构。
路易斯的共价键概念初步解释了一些原子形成简单共价分子的过程及共价键和离子键的区别。但其也有局限性,它存在下列几个方面的不足:
(1)路易斯的共价键概念未能阐明共价键的本质和特性。例如,它不能说明为什么共用电子对能使两个原子牢固地结合在一起。
(2)路易斯的共价键概念未能解释许多化合物的中心原子的外围电子数超过8个仍然很稳定的事实。如PCl5分子中磷原子的外围电子数是10个而不是8个。
为了解决这些问题,德国化学家海特勒(W. Heitler)和伦敦(F. London)等人于1927年首先把量子力学理论应用到分子结构中,后来鲍林(L. C. Pauling)等人又加以发展,建立了现代价键理论(valence bond theory),简称VB法(又叫电子配对理论)。1932年,美国化学家慕利肯(R. S. Mulliken)和德国化学家洪特(F. Hund)从不同于价键理论的角度,提出分子轨道理论(molecular orbital theory)简称MO法。这样,20世纪30年代以后,形成了两种现代共价键理论——现代价键理论和分子轨道理论。
共价键的类型
氮气分子是两个氮原子通过共用三对电子结合而成的,氮气分子中存在氮氮三键。氮原子核外有三个未成对电子,当两个氮原子结合成氮气分子时,两个氮原子的px轨道沿x轴方向以“头碰头”的方式发生重叠,而py-py和pz-pz轨道只能以相互平行的方式发生重叠(图)。
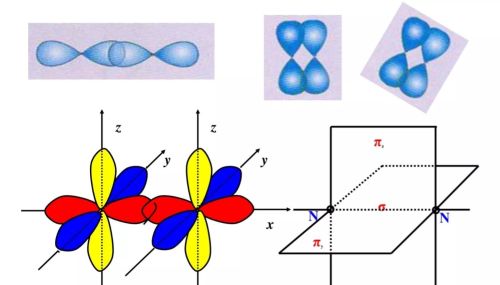
氮气分子中原子轨道的重叠方式
原子轨道沿核间连线方向以“头碰头”的方式重叠形成的共价键叫作σ键;原子轨道在核间连线两侧以“肩并肩”的方式重叠形成的共价键叫作π键。
氮气分子中含有一个σ键和两个π键,氮气分子的结构可用结构式N≡N表示。
乙烷分子中碳原子与碳原子之间形成一个σ键,乙烯分子中碳原子与碳原子之间形成一个σ键和一个π键,乙炔分子中碳原子与碳原子之间形成一个σ键和两个π键。 乙烯和溴发生加成反应时,乙烯分子双键中的一个π键断裂,两个碳原子各与一个溴原子结合;乙炔和足量溴发生加成反应(即完全加成)时,乙炔分子三键中的两个π键断裂,两个碳原子各与两个溴原子结合。
在有机化合物中,碳原子与碳原子之间形成π键的重叠程度比σ键的小的多。所以,碳原子与碳原子之间形成的σ键比π键牢固,化学反应中,π键往往容易断裂。
苯分子中的共价键
苯分子中,每个碳原子都分别与1个氢原子、2个碳原子形成σ键,同时,每个碳原子各有一个垂直于分子平面的p轨道,形成了一个以6个碳原子为中心的π键。苯的这种结构使任意两个相邻碳原子间形成的共价键的键能和核间距离完全相同。
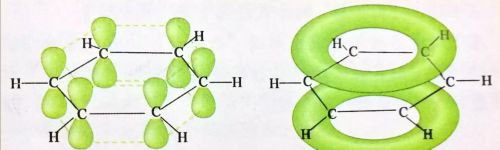
苯分子中的π键示意图
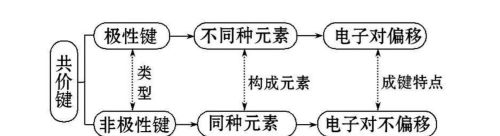
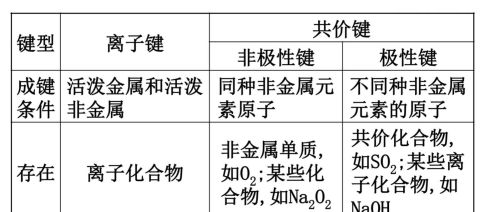
当原子间形成共价键时,当两个成键原子吸引电子的能力相同,工艺。共用电子对不发生偏移,这样的共价键叫作非极性共价键,简称非极性键(Non-polar bond);若两个成键原子吸引电子的能力不同,共用电子对发生偏移,这样的共价键叫作极性共价键,简称极性键(polar bond)。
例如,氢气分子中氢原子与氢原子之间和氟气分子中氟原子与氟原子之间的共价键是非极性键,氟化氢分子中氢原子与氟原子之间的共价键是极性键。在极性共价键中,成键原子吸引电子能力的差别越大,成键原子吸引电子能力的差别越大,共用电子对的偏移程度越大,共价键极性越强。
通常可以根据元素的电负性差值来判断键的极性强弱。一般情况下,两种成键元素间的电负性差值越大,它们形成的共价键极性就越强。根据元素电负性差值大小,下列键的极性由强到弱的顺序为:
F—H>O-H>N-H>C-H
氮原子和氢原子形成共价键时,氮原子提供3个未成对电子与3个氢原子形成3对共用电子对,g还有1对电子未与其他原子共用,这对电子称为孤电子对。当氨分子遇到氢离子时,氨分子中的氮原子提供孤电子对与氢离子形成共价键,即氨分子中氮原子上的孤电子对所占据的轨道与氢离子的1s空轨道发生重叠形成共价键,从而形成铵根离子。
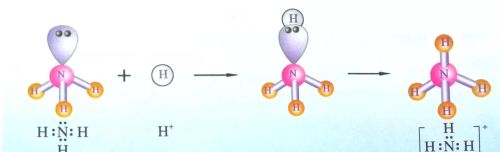
铵根离子形成过程
由一个原子提供孤电子对与另一个有空轨道可接受电子的原子形成共价键,这类共价键称为配位键(coordination bond)。

配位键
在表示分子或离子的结构式时,常用“→”表示配位键,其箭头指向接受孤电子对的原子,如铵根离子的结构式可用下图表示。在铵根离子中,4个N—H是相同的。
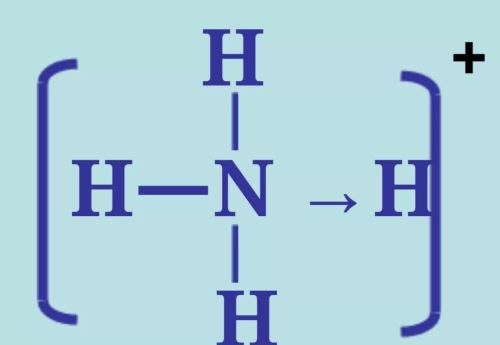
铵根离子的结构式
共价键键能与反应热
原子之间形成的共价键的强度可以用键能来描述。在101kPa、298K条件(常温常压)下,1mol气态AB分子生成气态A原子和B原子的过程中吸收的能量,称为AB间共价键的键能。例如,在此条件下使1molH2离解成氢原子时需要吸收436kJ的能量,则H—H键的键能为436kJ/mol。
键能可通过实验测定,但更多是通过推算获得的。例如,断开CH4中的4个C—H所需能量并不相等,因此,CH4中的C—H键能只能是平均值,而表中的C—H键能是更多分子中的C—H键能的平均值。
当两个原子形成共价键时,原子轨道重叠程度越大,共价键的键能越大,两原子核间的平均间距——键长(bond length)越短。键长是构成化学键的两个原子的核间距。由于分子中的原子处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距。

键长的判断方法
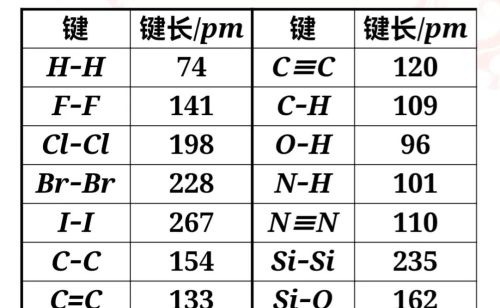
部分共价键的键长

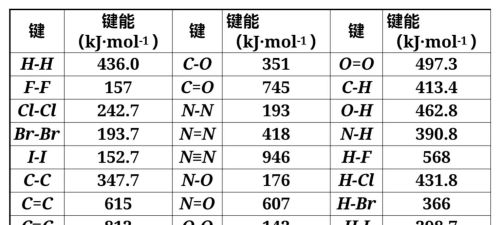
部分共价键的键能
化学反应的实质是旧化学键的断裂和新化学键的形成。如果化学反应中旧化学键断裂所吸收的总能量大于新化学键形成所放出的总能量,该化学反应为吸热反应;反之,该化学反应为放热反应。所以,反应物和生成物中化学键的强弱直接决定化学反应过程中的能量变化。
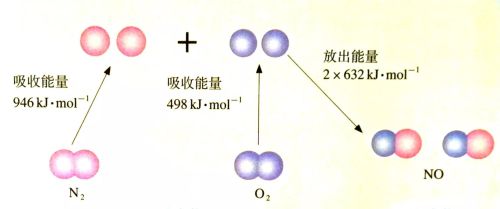
氮气(g)和氧气(g)生成一氧化氮(g)过程中的能量变化
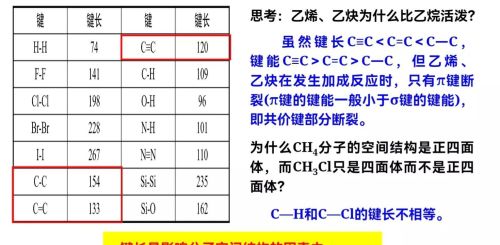

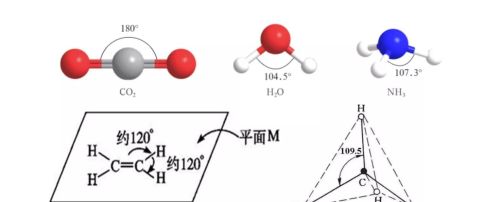
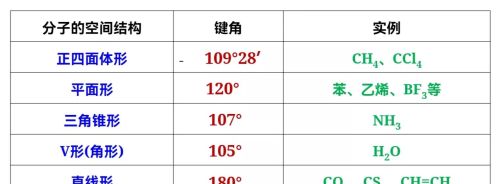
键角是多原子分子中两个相邻共价键之间的夹角。分子的元素组成和化学键键长使分子有一定的空间结构,一种类型的空间结构有与之相应的键角。多原子分子中的键角一定,表明共价键具有方向性。键角是描述分子空间构型的重要参数,分子的许多形质都与键角有关。
甲烷和氯气的反应机理
甲烷和氯气的反应原理属于自由基原理Cl2 —光照→ Cl· + Cl· (氯气分子光照后变为原子)CH4 + Cl· —→ CH3· + HCl(甲烷+氯原子→甲基+氯化氢)CH3· + Cl2 —→ CH3Cl + Cl·CH3Cl + Cl· —→ CH2Cl· + HClCH2Cl·+ Cl2 —→ CH2Cl2 + Cl·
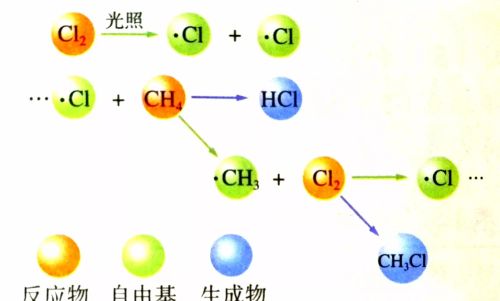
氯气与甲烷的反应机理
共价晶体
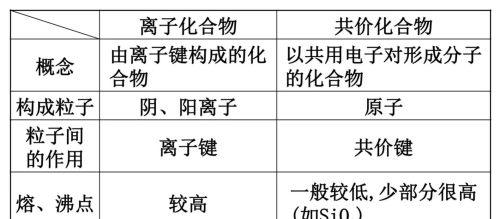
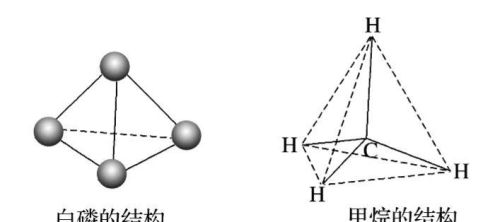
自然界中有一类晶体像金刚石一样,晶体中所以原子通过共价键结合,形成空间网状结构,这样的晶体叫共价晶体(covalent crystal)。晶体硅(Si)、金刚砂(SiC)、二氧化硅(SiO2)等都属于共价晶体。由于共价键的键能大,共价晶体一般具有很高的熔、沸点和很大的硬度。

金刚石
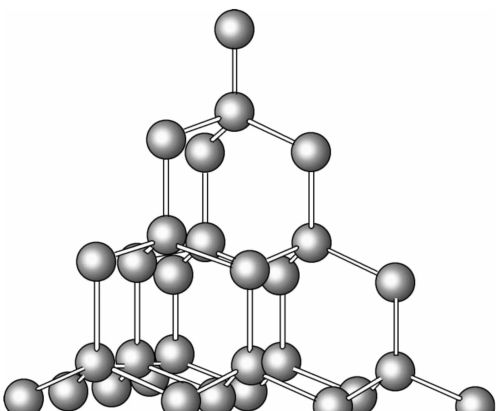
金刚石立体结构示意图
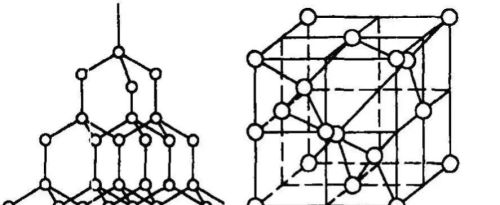
金刚石示意图

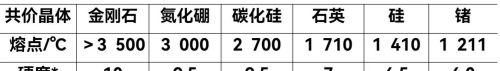
部分共价晶体的熔点和硬度
对于结构相似的共价晶体而言,共价键的键长越长,键能越小,晶体的熔、沸点越低,硬度越小。
温馨提示:通过以上关于共价键 共价晶体内容介绍后,相信大家有新的了解,更希望可以对你有所帮助。