溶液的定义初中化学(溶液的定义和特征)
初三化学下册,溶液的定义与溶液的特征讲解
溶液的定义和特征、溶液的凝固点、沸点、导电性是初中化学学习的重点内容,需要理解掌握。
1、溶液的定义与特征
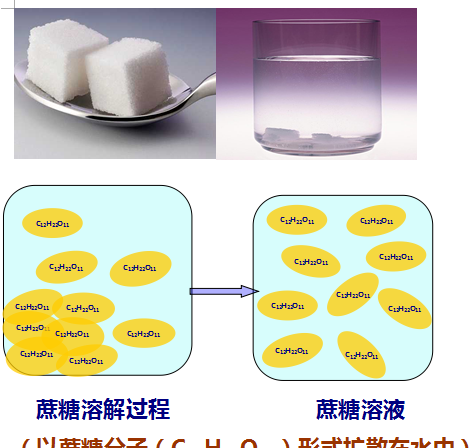
溶液的定义:一种或一种以上的物质以分子或离子的形式分散到另一种物质中,形成均一、稳定、透明的混合物。
1.1、溶液的特征
①一种或一种以上的物质以分子或离子的形式分散到另一种物质形成的混合物
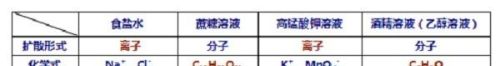
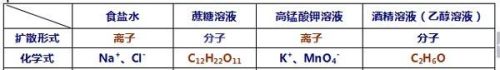
食盐水(一种物质以离子的形式扩散到另一种物质)
食盐(NaCl)(一种物质)以离子的形式扩散到水(另一种物质)中形成食盐水溶液

蔗糖水(一种物质以分子的形式扩散到另一种物质)
蔗糖(C12H22O11)(一种物质)以分子的形式扩散到水(另一种物质)中形成蔗糖水溶液
②溶液的均一性
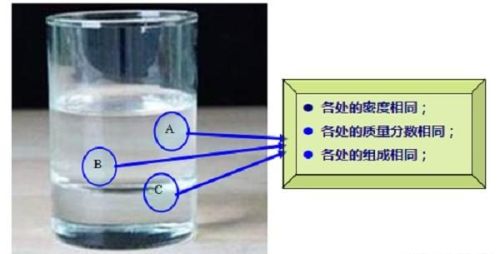
溶液的均一性:溶液中各部分的浓度、密度、组成、溶质质量分数和性质完全一样。
如从一杯食盐水中任意位置取出一部分食盐水,那么这些取出的食盐水的都一样咸,而且密度、NaCl质量分数也一样。
②溶液的稳定性
溶液的稳定性:当不改变外界条件(温度、溶剂和溶质的量)时,溶液长久放置,不会出现分层、沉淀等现象。

③溶液的透明性
溶液的透明性:指光线可以透过溶液;

溶液的颜色与溶液的透明不同,无色溶液和有颜色的溶液都可以是透明的。
如蓝色的硫酸铜溶液(CuSO4)是透明的。

如紫色的高锰酸钾溶液(KMnO4)也是透明的。

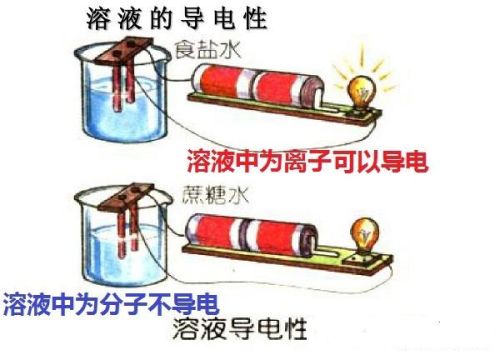
1.2、溶液的导电性
溶液的导电性与溶液中存在的自由离子有关,自由离子浓度越大,溶液的导电能力越强。
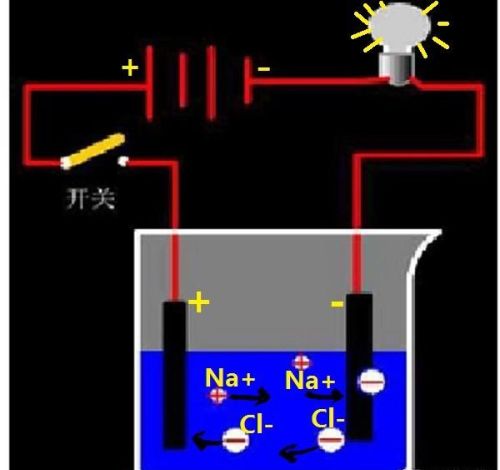
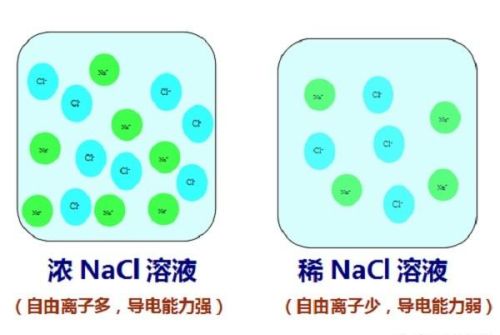
纯净的水导电能力较差,蒸馏水几乎不导电;
以分子形式存在的溶液,导电能力弱或不导电,如蔗糖溶液;
1.3、溶液的浓度对凝固点、沸点的影响
同温同压下,在相同的溶剂中加入的溶质越多(溶液的浓度越大),溶液的沸点会升高,凝固点会降低。
①纯净水与食盐水(NaCl溶液)
食盐水中含有NaCl(溶质)较多,纯水中不含NaCl(溶质),所以食盐水的凝固点低于纯水,沸点高于纯水。

生活事例:
1、冬天越干净的水容易结冰,脏水不容易结冰?
解释:越干净的水水中溶解的物质较少,凝固点高,容易结冰。脏水中溶解很多物质,凝固点低,不容易结冰。
2、沸腾的汤比沸腾的水温度高?
解释:汤中溶解的物质较水中的多,汤的沸点比水高,所以汤沸腾时的温度比水沸腾时的高。

3、冬天为加速雪融化,防止雪上冻,向雪中散盐(工业盐,主要成分NaCl)。
解释:盐会溶入雪水中,形成盐水(溶液),盐水结冰的温度低于水结冰的温度,所以雪会融化成水,不会结冰。

2、悬浊液和乳浊液
2.1、悬浊液(固体+液体):将泥土(或粉笔灰)加入水中经搅拌后,会以细小固体颗粒物形式分散于水中,形成悬浊液。
知识点:
①悬浊液不是溶液,长久放置后会出现沉淀现象
②悬浊液是以固体小颗粒分散于水中,不是以分子或离子的形式扩散的。

2.2、乳浊液(油+液体):将食用油(或其他油类物质)加入水中经搅拌后,会以小油滴的形式分散于水中,形成乳浊液。
知识点:
①乳浊液不是溶液,长久放置后会出现分层现象,油比水轻,上层为油层,下层为水层。
②乳浊液是以小油滴的形式分散于水中,不是以分子或离子的形式扩散的。

牛奶和豆浆都不属于溶液
牛奶和豆浆中都含有蛋白质分子,蛋白质分子直径大小在1nm~9nm之间,超出了溶液中分子与离子的直径大小(溶液中分子或离子大小<1nm),所以牛奶和豆浆属于胶体,不属于溶液。

温馨提示:通过以上关于初三化学下册,溶液的定义与溶液的特征讲解内容介绍后,相信大家有新的了解,更希望可以对你有所帮助。