2运用周期表有机物物理性质规律推理的例子(有周期现象的实际例子)
导语:2.运用周期表、有机物物理性质规律推理的方法3. 算密度的方法
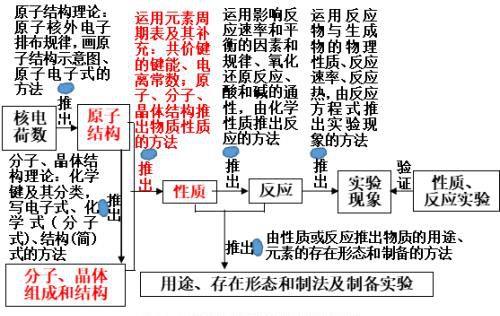
四、学习物质的初级思维方式和发展到高级思维方式
(二)学习物质的初级思维方式时形成的化学理论或获得的方法
VII、运用元素周期表及其补充:共价键的键能、电离常数;原子、分子、晶体结构推出物质性质的方法
即图2(化学的高级基本思维方式)中的红色部分:
三、推出物质性质的方法
(一)由物质结构、元素周期表推出物质的物理性质的方法:
物理性质:不需要通过化学变化体现的性质。包括:物质本身固有的性质:某条件下,物质的颜色、光泽、状态、气味(生物作用)、密度;通过物理变化体现的性质:溶解性或溶解度、熔点、沸点、挥发性、硬度、导电性、传热性、延展性。
2.运用周期表的规律、各类有机物物理性质的变化规律推出所学物质的物理性质的方法:
(1)第2、3周期中,同一周期元素的单质的熔沸点从第IA族到第IVA族依次升高,从第IVA族到0族依次降低。
(2)在第IA、IIA族中,同主族金属单质的熔沸点从上到下依次降低。
(3)在第IIIA、IVA族中,熔沸点:硼>铝;金刚石>硅晶体。
(4)在第VA、VIA族中,同一主族从第2周期到第4周期元素的单质的熔沸点依次升高,常温常压下的状态从气态变到固态,颜色加深。
(5)第VIIA族元素的单质的熔沸点从上到下依次升高,常温常压下的状态从气态变为液态,变为固态,颜色加深,从氟气的浅黄绿色变到氯气的黄绿色,变到液溴的红棕色,变到碘单质的紫黑色。
(6)第0族元素单质的熔沸点从上到下依次升高。
(7)烃的状态的变化规律:含1到4个碳原子的烃在常温常压下为气态,含5到16个碳原子的烃在常温常压下为液态,含17个碳原子以上的烃在常温常压下为固态。
3. 在标准状态下,所学物质是气态时,其密度计算的方法:
ρ(标准状态,气体)
=(Mg/mol)/(22.4L/mol)(学习气体摩尔体积时认识,也可据此公式比较在同温同压下,不同气体密度的大小)。
本文内容由快快网络小婷创作整理编辑!