中学化学之离子反应中的疑难点解读答案(离子反应中的问题)
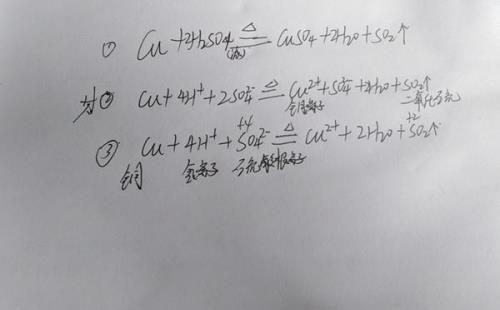
导语:中学化学之离子反应中的疑难点解读
前面讲到过氧化还原反应,今天跟大家聊聊离子反应。在离子反应中,主要看生成的产物是否满足这三个基本的条件,即是否有无气体生成,是否有无沉淀物或微溶物生成,是否有无难电离的物质生成。在一个化学反应中,只要满足以上条件中的任何一种,绝大多数都可以用离子方程式来表达其化学反应的实质。
那么,是不是所有满足上述条件的反应都可以用离子方程式来表达出来呢?
上图中的化学反应为铜(Cu)与浓硫酸(H2SO2)在加热条件下生成硫酸铜(CuSO4),水(H2O) 和二氧化硫(SO2)气体。根据离子反应的条件,这个化学反应中生成了气体SO2,貌似是可以写成离子方程式的。
但是,浓硫酸与稀硫酸不同的是,当硫酸的质量分数占到70%以上时,此时的硫酸溶液才称之为浓硫酸。在化学中,浓硫酸具有很强的吸水性,浓硫酸在水溶液几乎不电离,而是以硫酸分子的形式存在,故而,铜与浓硫酸的反应不能用离子方程式给表达出来。
扩展:浓硫酸具有强氧化性,能发生碳化反应,如果人的皮肤一旦接触到浓硫酸,那么皮肤组织与浓硫酸发生碳化反应后,皮肤就会变成炭黑。那么,皮肤在接触稀硫酸时,会不会碳化呢?
在稀硫酸溶液中,随着稀硫酸中的水分蒸发,附着在皮肤表面的稀硫酸也会逐渐变成浓硫酸,如果不及时用清水将皮肤表面的稀硫酸清洗干净的话,稀硫酸变成浓硫酸后一样会使皮肤发生碳化反应,从而使皮肤变为炭黑。那么,中学化学中常见的物质中,有哪些容易在水中电离的呢?
我们知道纯净的水是不能导电的,如果往纯净的水里加入一定量的离子后,再往水中通电,那么这时的水溶液就能导电了。根据有些物质在水溶液中电离出离子的浓度强弱的不同,我们又可以人为的分为强电解质与弱电解质。
在中学化学中,常见的强电解质有强酸、强碱、绝大数的盐。例如强酸有盐酸,硝酸,硫酸等,强碱有氢氧化钾、氢氧化钠、氢氧化铁等。而弱电解质有弱酸、弱碱等,例如:强酸有醋酸、碳酸、硅酸等,弱碱有氨水,氢氧化铝等。非电解质一般为蔗糖、气体等。
在中学阶段,常见的难容物质又有哪些呢?
例如在初中化学阶段学习的碳酸钙(CaCO3)、后来在高中化学阶段认识的诸如氯化银(AgCl)、硫酸钡(BaSO4)、氢氧化镁{Mg(OH)2},氢氧化锌{Zn(OH)2},碳酸钡(BaCO3),碳酸铜(CuCO3)等,以及微溶物{Ca(OH)2}、硫酸钙(CaSO4)和碳酸镁(MgCO3)等。
为什么在此要介绍难溶于水的物质呢?
因为在离子反应中,溶液中离子浓度总是向着减少离子浓度方向进行着,在化学反应中,生成的难溶物质,气体,或弱电解质都是减少了溶液中离子的浓度,因此一部分的化学反应是可以用离子方程式来表达的。而离子方程式表达的一类化学反应,而不是一种化学反应。
例如:
在上图的离子方程式中,主要是氢离子与氢氧根离子反应生成了水。这个离子反应中,既可以表示盐酸与氢氧化钠(NaOH)的反应,也可以表示盐酸与氢氧化钾(KOH)的反应。因此这个离子方程式可以被强酸与强碱之间的反应通用。
那么,如何正确书写离子方程式呢?
第一步:首先书写正确的化学方程式,以硫酸铜与氯化钡反应为例:CuSO4+BaCl2==BaSO4↓+CuCl2,由于此化学方程式中有强电解质硫酸铜、氯化钡、氯化铜,也有难溶于水的硫酸钡,因此,这个化学方式可以用离子方程式来表达。
第二步:写离子方程式,把易溶于水,易电离的物质写成离子形式,难溶物质或难电离的物质或气体仍然用化学式书写,则有
第三步:删去方程式等号两边不参加反应的离子,即将等式右边的离子移到等式左边,然后做数学上的减法就可以删掉没有参加反应的离子了,则离子方程式为
在最终的离子方程式中,我们要注意检查该离子方程式的左边与右边的电荷数是否相等,检查离子方程式左右两边的原子个数是否相等,如果是相等的话,则离子方程式才能算是正确的?
写在最后,在离子反应中,微溶物如碳酸镁(MgCO3)到底写化学式呢还是写离子式呢?
本文内容由快快网络小馨创作整理编辑!