如何判断化合物中元素原子团的化合价(化合物怎样判断)
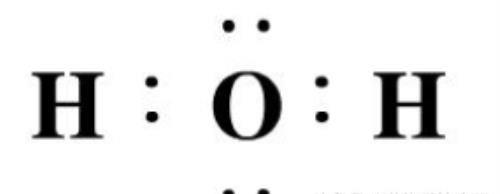
导语:高中化学小技巧——如何判断化合物中各原子达到最外层8电子结构
判断原子最外层是否满足8电子稳定结构的试题,这类试题中所涉及的物质都是用共价键结合的共价化合物或非金属单质,对于离子键结合的化合物从不判断。
一般情况下,共用电子对数和化合价绝对值相等,因此我们可以有以下的判断方法:
第一步:看物质中有没有氢元素或稀有气体元素。若有,则肯定不会满足8电子结构。
第二步:想一下这些物质在学习过程中是否书写过它的电子式,若书写过,则肯定满足8电子结构。
第三步:标出物质中各元素的化合价,按“原子的最外层电子+化合价绝对值”计算,若结果等于8,则满足8电子稳定结构。
在使用此方法时,要按步骤来,例如经过第一步后,像水,氨气等物质中由于存在氢元素,就不可能满足8电子稳定结构了。
例题:下列各分子中所有的原子都满足最外层有8电子稳定结构的是( )
A. H2S B. PCl3 C .N2 D.BCl3
分析:第一步:在A答案中有氢元素,所以肯定不是正确答案。第二步:在C答案中的氮气是课本上要求书写电子式的物质,因此肯定满足。第三步:在B答案中磷标+3价,氯标-1价,计算:磷 最外层电子数5+化合价绝对值3=8,满足8电子稳定结构,氯 最外层电子数7+化合价绝对值1=8,满足8电子稳定结构。所以B满足8电子稳定结构。在D答案中硼化合价为+3价,氯化合价为-1价,计算:硼 3+3=6,不满足;氯7+1=8,满足。因此D不满足要求。
练习:
下列各分子中所有原子都满足最外层为8电子结构的是
A. BeCl2 B. PCl3 C. PCl5 D. N2
下列分子中所有原子都满足最外层为8电子结构的是
A. BF3 B. H2O C. SiCl4 D. PCl5
答案为:BD C
免责声明:本站部份内容由优秀作者和原创用户编辑投稿,本站仅提供存储服务,不拥有所有权,不承担法律责任。若涉嫌侵权/违法的,请反馈,一经查实立刻删除内容。本文内容由快快网络小欣创作整理编辑!