交换膜在中学电化学中的作用(通过交换膜的电荷数和转移电子数)
导语:高中化学知识点讲解——交换膜原理在电化学考题中的应用

一、离子交换膜
离子交换膜是一种含离子基团的、对溶液里的离子具有选择透过能力的高分子膜一般在应用时主要是利用它的离子选择透过性,所以也称为离子选择透过性膜.根据透过的微粒可分为阳离子交换膜、阴离子交换膜等.电解饱和食盐水利用的就是阳离子交换膜,阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过;而阴离子交换膜就只允许阴离子透过了。
1.阳离子交换膜的应用
例1如图1为阳离子交换膜法电解饱和食盐水原理示意图,下列说法不正确的是( )。 本文来自化学自习室!

A.从E口逸出的气体是H2
B.从B中加人含少量NaOH的水溶液以增强导电
C.标准状况下每生成22. 4LC1:便产生2 molNaOH
D.完全电解后加适量盐酸可以恢复到电解前的浓度
解析:本题来源于课本,从Na+在阳离子交换膜的流动方向可知D处为阴极,H+在此处放电产生氢气从E口逸出;A处是氯化钠溶液进口,Cl2从左出气口放出,加盐酸可以恢复NaCl的物质的量,但不能恢复其浓度。选D。
2.阴离子交换膜的应用
例2如图2所示,下列叙述正确的是( ).

A. Y极为阴极,发生还原反应
B. X极为正极,发生氧化反应
C. Y极与滤纸接触处有氧气生成
D. X极与滤纸接触处变红
解析:左侧装置相当于一个原电池,只有CuSO4溶液中的阴离子SO42-透过离子隔膜游向负极区,锌失去电子,通过外电路流向铜极,原电池提供了直流电用活泼电极铜电解硫酸钠溶液,X极与电源的正极相连作阳极,Cu本身溶解发生氧化反应,电极反应式为:Cu -2e-= Cu2+, Y极与电源的负极相连作阴极,发生还原反应,电极反应式为:2H++ 2e-=H2,因此Y极与滤纸接触处变红.选A
3.综合考查阴、阳离子交换膜
例3如图3(1)是铝碱工业中离子交换膜电解槽示意图,其中离子交换膜为阳离子交换膜,它有一种特殊的性质—只允许阳离子通过,阻止阴离子和气体通过。
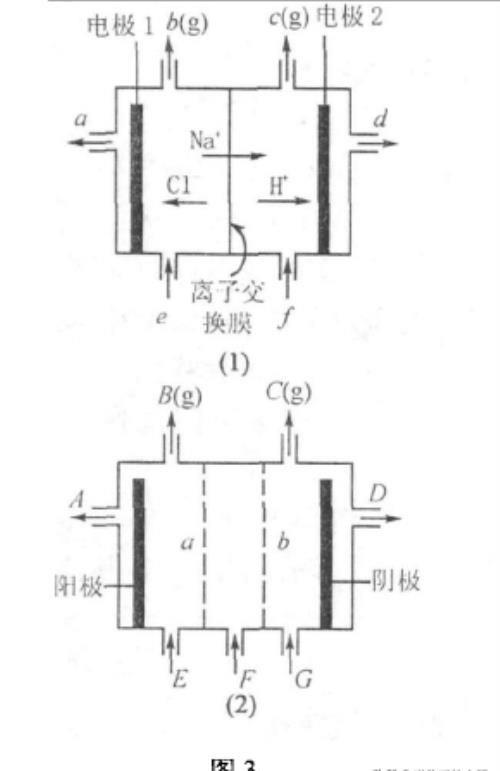
(1)电解后得到的氢氧化钠溶液从 口流出(填字母代号),b口排出的是 气体,电极1应连接电源的 极(填“正”或“负”);理论上讲,从f加人纯水即可,但在实际生产中,纯水要加人一定量的NaOH溶液,其原因是 和 .
(2)图3(2)是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答,a为 (填“阳”或“阴”)离子交换膜;从E口流进的物质的化学式(若为溶液,则写出溶质的化学式)为:
解析:(1)氢氧化钠的产生是因为在阴极氢离子得电子生成了氢气,留下的氢氧根离子与钠离子结合生成了氢氧化钠,所以应该从d处流出.b口处的电极是阳极,由放电顺序氯离子失去电子生成氯气,电极1为阳极,所以连电源的正极.如果只加纯水,溶液的导电能力太弱,不利于电解反应. 本文来自化学自习室!
(2)由图3(2)知:a边的电极为阳极,阳极处阴离子失去电子发生氧化反应,所以a应该是阴离子交换膜.由阴阳离子放电顺序知,电解Na2SO4溶液实际是在电解水,阳极是OH-失去电子.D口这边是阴极,氢离子得电子后留下的氢氧根离子与钠离子结合产生NaOH. E口进人的为水(加人少量的稀硫酸)。
答案:(1) d Cl2 正 增强溶液的导电性 不影响NaOH的纯度 (2)阴 H2O (加少量稀硫酸)
二、质子交换膜
质子交换膜,与一般化学电源中使用的隔膜有区别。这种膜不传导电子,是氢离子的优良导体,于质子交换膜只能传导质子,因此氢质子可直接穿过质子交换膜到达阴极,而电子只能通过外电路才能到达阴极。当电子通过外电路流向阴极时就产生了直流电,它既是电解质提供氢离子的通道,又可以作为隔膜隔离两极反应气体。膜的两边是气体电极,如氢氧燃料电池,阳极为氢电极,阴极为氧电极.在酸性介质中,两电极的反应分别为:阳极(负极):2H2一4e-=4H+;阴极(正极):O2 +4e-+4H+= 2H2O;在碱性介质中发生的电极反应为:阳极(负极):2H2+4e-+4OH- =4H2O,阴极(正极):O2+4e-+2H2O=4OH- 。
例4、新型的乙醇电池结构如图4所示,它用碘酸类质子溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全.已知电池总反应式为C2H5OH+3O2

2CO2 +3H2O.下列图4说法不正确的是( ).

A. a极为电池的负极,该电极发生氧化反应
B.电池工作时电流由b极沿导线经灯泡到a极
C.电池正极的电极反应式为O2+2H2O + 4e-=4OH-
D.电池工作时,lmol C2H5OH被氧化转移12mo1电子
解析:乙醇燃料电池,质子即H+透过质子交换膜,从a流向b,氧气通人的一极b为正极,在碘酸类质子(H+)溶剂中发生还原反应,正极电极反应式为:O2 +4e-+4H+=2H2O,故C错,则a为负极,负极发生氧化反应,电流由正极流向负极,即由b到a.由于乙醇化合价较复杂,lmol C2H5OH转移的电子,就是3 mol O2得到的,即为12 mol,所以符合题意的选项为C.
免责声明:本站部份内容由优秀作者和原创用户编辑投稿,本站仅提供存储服务,不拥有所有权,不承担法律责任。若涉嫌侵权/违法的,请反馈,一经查实立刻删除内容。本文内容由快快网络小蔼创作整理编辑!