> 教育
碳元素只能形成四个键吗(碳元素只能形成四个键的原因)
导语:碳元素只能形成四个键?
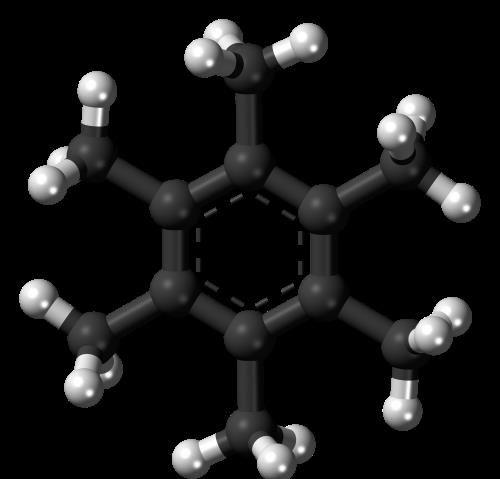
教科书教给我们一个知识:共价键是由成键的两个原子共享一个电子对形成的,每个成键原子贡献一个电子。那么,碳元素(C)有四个最外层电子,理应形成四个共价键。然而,事实并非如此。在20世纪70年代,德国科学家制备了一个被称为“六甲基苯”的分子(如图1所示)。在这个分子中,六个碳原子形成一个平面的六角环,环上每一个碳原子刮着另一个碳原子,而这个碳原子又和三个氢原子相连。这样,环上的碳原子形成了三个共价键,剩下的电子在环内自由运动。
图1:六甲基苯结构
当时,科学家进一步推断,如果从六甲基苯分子中去掉两个电子,让这个分子带正电,那么,这个分子的形构将会发生重大变化,使得一个碳原子和另外六个碳原子相连,形成六个共价键。然而,科学家经过数以千计的尝试都没有把这个预言变为现实,直到最近,一组来自德国的科学家获得了重要突破。他们成功从六甲基苯中取走两个电子,并在强酸的环境下让新的到的分子稳定下来。通过X射线衍射技术,他们测定了新分子的结构。研究表明,六边环中的一个碳原子离开了原来的平面,与环内剩下的五个碳原子分别形成一个键,加上原来在外面的一个碳原子,这个离开了六边环的碳原子最总和六个碳原子分别形成一个键,总共形成六个键(如图2所示)。这是人们第一次观察到一个碳原子形成超过四个键。
图2:新分子的结构
当然,需要指出的是,这并不是传统意义上认为的由两个电子形成的共价键;然而,它让人们对化学键有了新的认识。
本文内容由小故整理编辑!