氨和氮的关系(氮和铵有什么关系)
导语:氮及其化合物课时2氨和铵盐
【知识点1】氨
1氨的物理性质
氨气是 色、有 气味的气体,密度比空气 ,极易溶解于 (1:700)。氨很容易液化,液化时 热。液氨汽化要 大量热量,故液氨常用作 剂。
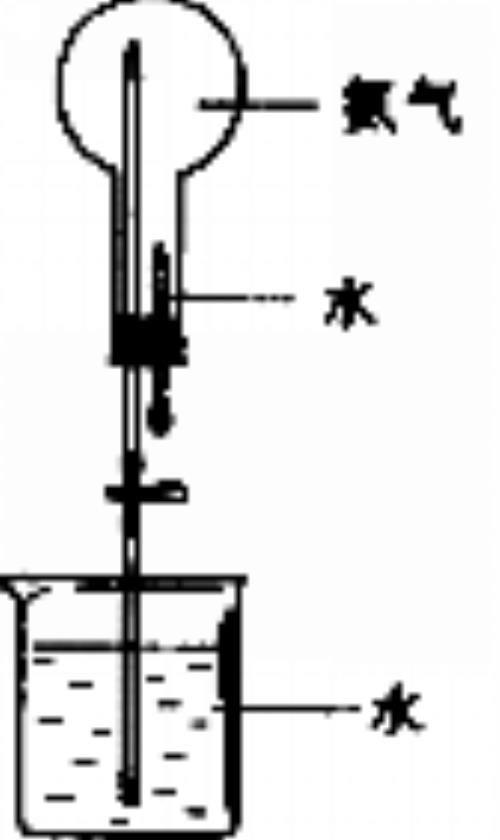
【实验5-6P13】如图5-11所示,在干燥的圆底烧瓶里充满
NH3,用带有玻璃管和胶头滴管(先吸入水)的橡胶塞塞瓶口。倒
置烧瓶,使玻璃管插入盛有水的烧杯中(先在水中滴入少量酚酞
溶液)。打开弹簧夹,挤压胶头滴管,使水进入烧瓶。观察并描
述现象,分析出现这些现象的可能原因。
现象: 。
结论: 。
实验原理: 。
实验成功的关键: 。
2氨的化学性质
(1)氨与水的反应
氨溶于水,会与水结合成一水合氨( ),一水合氨中有 部分(1%)电离成
和 。故在氨水溶液中存在如下平衡: 。
氨的水溶液(俗称 )显弱碱性,能使酚酞溶液变 或 色石蕊试纸变 。氨水中存在的分子有 、H2O等(其中不稳定的分子为 ),存在的离子有 等。 但通常把 当作氨水的溶质,如0.1mol/L氨水中: =
01mol/L。氨水的密度比水 ,而且密度随浓度的增大而 。
⑵与酸反应
氨气与HCl气体反应: ;现象 : 。
氨气通入盐酸溶液中: ;离子方程式: 。
氨水与盐酸反应: ;离子方程式:
(3)氨的催化氧化
(此反应为工业制硝酸的基础)
【知识点2】铵盐
绝大多数铵盐易溶于 ,受热易 ,与碱反应产生 。
1铵盐不稳定,受热分解
氯化铵的分解:
碳酸氢铵分解:
硝酸铵的分解(生成物中有N2、O2等):
提示:铵盐受热易分解,但不是所有的铵盐分解都产生 。
2铵盐与碱反应:
(1)氯化铵与固体氢氧化钠固体混合加热: 。
(2) 氯化铵溶液与氢氧化钠溶液反应的离子方程式为: 。
(可用此原理检验溶液中的NH4+)
。
【实验5-7】向盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液的三支试管中分别加入NaOH溶液并加热(注意通风),用 夹取一片湿润的红色石蕊试纸放在试管口,观察现象,分析现象产生的原因,写出反应的离子方程式。
现象: 。
离子方程式: 。
(3)氨的实验室制法(见P 15图5-13)
在实验室里,常用加热 盐和 的混合物的方法制取氨。由于氨易溶于水,常用向 排 法来收集。
①反应原理:
②发生装置: 型装置。与制备 等气体的装置相似。
③NH3的检验:a.用 检验。b.用 检验。
④NH3的干燥:NH3通常用 干燥。不能用 作干燥剂。
⑤试管口棉花的作用: 。
⑥注意事项:反应装置中试管口须 。选用药品时最好用新制的 。余氨的吸收: 。
本文内容由快快网络小悦创作整理编辑!