碳的氧化物性质用途及制法是什么(碳的氧化物性质和用途)
导语:碳的氧化物性质、用途及制法
1.CO的理化性质及用途
A.物理性质:无色无味,密度比空气略小,难溶于水
B.化学性质:可燃性,还原性,剧毒
可燃性:CO燃烧呈蓝色火焰,燃烧放出大量热,是水煤气的主要成份

还原性:CO在加热条件下能将金属氧化物还原为金属单质,是冶炼金属的原料

C. CO用途
CO具有可燃性,常用作气体燃料;CO具有还原性,可用于金属冶炼;CO具有毒性(极易与血液中的血红蛋白结合,使生物体缺氧,严重时危及生命),冬天用煤炉取暖时,一定要注意室内通风,防治CO中毒
2.CO2性质
A. 物理性质

B. 化学性质
①既不燃烧,也不支持燃烧
现象:下层的蜡烛先熄灭,上层的蜡烛后熄灭
结论:CO2不然烧也不支持燃烧;且密度比空气大
②与水反应
二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊溶液变成红色
碳酸很不稳定,容易分解生成CO2和H2O

③与碱反应
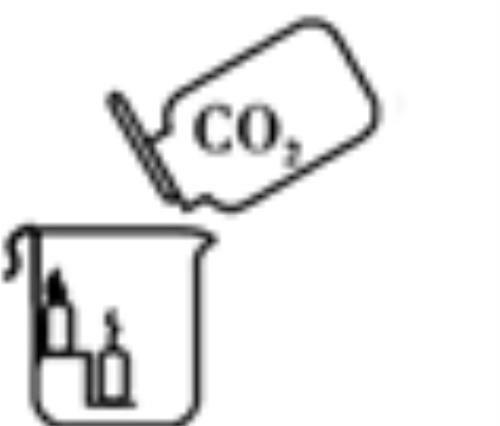
A.与澄清石灰水反应
现象:澄清石灰水变浑浊
化学方程式:
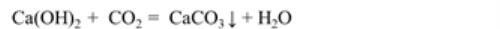
应用:实验室常用该反应检验CO2气体
B.与氢氧化钠溶液反应
化学方程式:
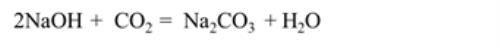
应用:实验室常用氢氧化钠溶液吸收剩余的CO2
3. CO2制备
A.工业制法:高温煅烧石灰石
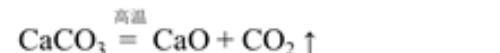
B实验室制法:
① 药品选择:大理石或石灰石与稀盐酸
②实验原理:
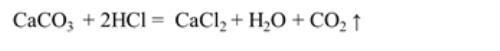
③ 发生装置:
Note:
a. 不可用硫酸代替盐酸,因为生成的硫酸钙微溶于水,覆盖在碳酸钙的表面,会阻止碳酸钙与硫酸接触,使反应难以继续进行。
b. 不可用碳酸钾、碳酸钠代替石灰石或大理石,因为碳酸钾、碳酸钠是粉末状固体,与稀盐酸反应速率太快,不利于反应的控制和气体的收集
c. 不可用浓盐酸,因为浓盐酸挥发出的氯化氢气体使二氧化碳不纯,且影响二氧化碳的性质检验
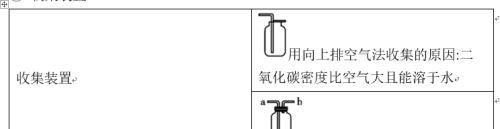
④ 收集装置
Note:
实验室制取二氧化碳时长颈漏斗末端须伸入液面以下,目的是防止生成的气体从长颈漏斗中逸出
⑤ 实验顺序:连接仪器⇢检查装置气密性⇢装入药品(先加固体,后通过长颈漏斗或分液漏斗加入液体)⇢收集⇢验满
⑥ CO2的检验与验满

免责声明:本站部份内容由优秀作者和原创用户编辑投稿,本站仅提供存储服务,不拥有所有权,不承担法律责任。若涉嫌侵权/违法的,请反馈,一经查实立刻删除内容。本文内容由快快网络小面创作整理编辑!